Till kvävefunktioner är en grupp av organiska föreningar som har atomer av kväve fäst vid kolkedjan. De kännetecknas av sina respektive funktionella grupper, som är uppsättningar av atomer kopplade i en viss konfiguration och som definierar de karakteristiska egenskaperna för varje funktion.
Kvävefunktionerna är:
aminer;
amider;
nitroföreningar;
nitriler;
isonitriler.
Läs också:Vilka är syrefunktionerna?
Sammanfattning av kvävefunktioner
Kvävefunktioner är organiska föreningar som innehåller atomer av kväve.
Aminer, amider, nitroföreningar, nitriler och isonitriler är kvävefunktionerna.
Oorganiska funktioner kännetecknas av sin funktionella grupp.
Aminer härrör från substitution av väte av ammoniak genom alkylradikaler.
Amider har samma kolatom ansluten till kväve och kol. syre.
Nitroföreningar innehåller gruppen -NO.2.
Nitriler kännetecknas av närvaron av en trippelbindning mellan kol och kväve.
Isonitriler har en trippelbindning mellan kväve och kolmed kväve fäst till kolkedjan.
Videolektion om kvävehaltiga funktioner
Vad är kvävefunktioner?
Kvävefunktioner är en uppsättning av organiska funktioner som har kväveatomen i sin struktur, förutom kol- och väteatomer. De är: aminer, amider, nitroföreningar, nitriler och isonitriler,
Det som skiljer de kvävehaltiga funktionerna åt är de respektive funktionella grupperna, som är det strukturella arrangemanget av atomer som ansvarar för ämnets egenskaper.
Vilka är kvävefunktionerna?
aminer
Den organiska funktionen gruvan kännetecknas genom att binda minst en kolkedja till kväveatomen. Den funktionella gruppen av aminer är -N-R1R2R3 (R-grupperna är kolkedjor eller väteatomer, av vilka åtminstone en är en kolkedja).

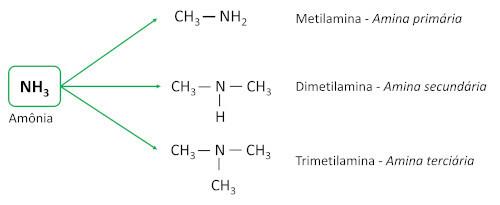
aminerna härrör från ammoniak (NH3) med en eller flera väteatomer ersatta med kolatomer eller alkylligander. De är grundläggande ämnen, lämnar pH mer än 7 i vattenlösning.
De klassificeras enligt mängden väteatomer som ersatts av kolligander (alkyl- eller arylgrupper), som kallas substituenter.
- Primära aminer: har en enda kolsubstituent.
- Sekundära aminer: har två kolsubstituenter.
- Tertiära aminer: har tre kolsubstituenter, det vill säga kväveatomen är inte längre bunden till någon väteatom, vilket skapar tre Anslutningar enkelt med kolatomer.
A nomenklatur för aminer följer riktlinjerna för IUPAC (International Union of Pure and Applied Chemistry). När det gäller primära aminer tar konstruktionen av namnet hänsyn till antalet kol (prefix), typen av bindning mellan kol (infix) och termen används gruvan för suffixet (slutet på ordet).

Se exemplet:
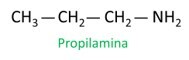
När du tilldelar siffror till kol för placeringen av radikaler, tilldela lägsta möjliga nummer till atomen närmast NH-gruppen.2.
För sekundära och tertiära aminer tar nomenklaturen hänsyn till den längsta substituentgruppen bunden till kvävet som huvudkedja, och de andra liganderna skrivs med prefixet som hänvisar till antalet kol och suffixet -il, med bokstaven N före dem.

Exempel:
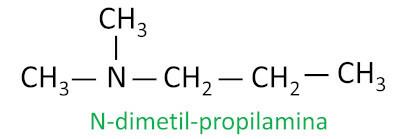
Amider
Den organiska funktionen amid karaktäriseras av binder en karbonylgrupp (C=O) till kväveatomen, där kväve kan bindas till kol- eller väteatomer.
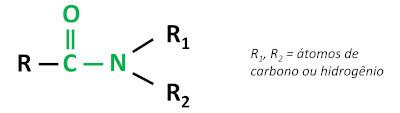
amiderna är grundläggande ämnenlämnande pH över 7 i vattenlösning. Ämnet urea tillhör gruppen amider och är en naturligt förekommande förening i urin, som härrör från nedbrytningsprocesser som sker i levande organismer.
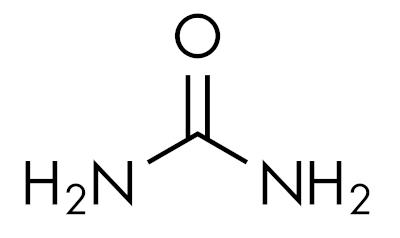
Amider är karakteristiska beroende på graden av kvävesubstitution. Så här:
- Primära amider: håller ihop två väteatomer med kväve.
- Sekundära amidereller monosubstituerad: en av vätena har ersatts av kolkedja, så kväve upprätthåller en enkelbindning med väte.
- tertiära amidereller förskjuten: Kväve har inte längre vätebindningar, som alla har ersatts av kol.

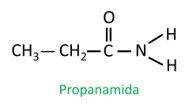
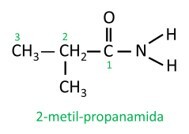
Amider är Namngiven enligt IUPAC, molekylerna namnges av sekvensen:

I grenad amid deltar kolatomen i amidgruppen i huvudkedjan, och kolantalet måste börja med det. Se:
 |
 |
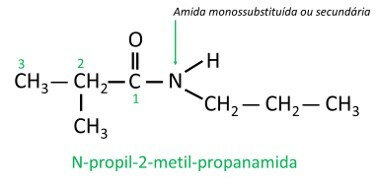
I monosubstituerade eller disubstituerade amider, bokstaven N anger grenens position som är fäst vid kväveatomen. Om det finns en annan radikal i kedjan kommer den att skrivas efter att den radikal som refererar till N har identifierats.
nitroföreningar
Du nitroföreningar är organiska föreningar som innehåller en nitrogrupp (-NO2) fäst till en kolkedja, som kan vara alifatisk (öppen eller linjär) eller aromatisk.
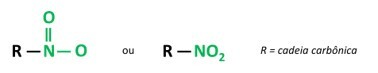
A det huvudsakliga kännetecknet för dessa ämnen är deras explosiva kraft. Den explosiva kapaciteten är förknippad med aromatiska nitroföreningar, och ju fler nitrogrupper desto större explosion. Alifatiska nitroföreningar används i laboratorier som organiska lösningsmedel.
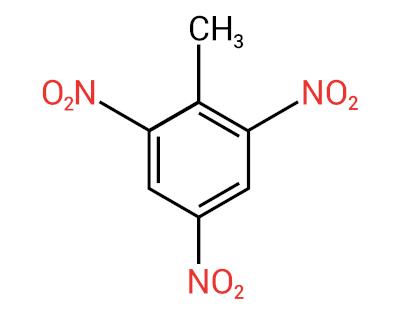
Nomenklaturen för dessa föreningar bildas av ordet nitro följt av namnet på kolväte (prefix + infix + ändelse -O).
Se några exempel:
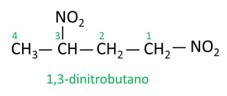 |
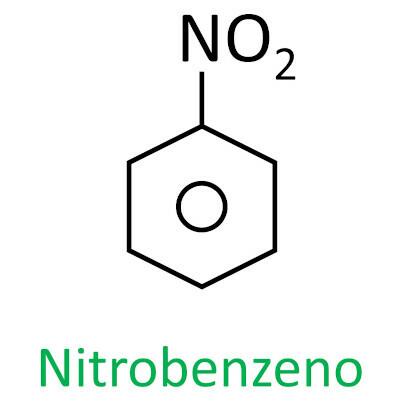 |
nitriler
Nitriler är organiska föreningar som kännetecknas av trippelbindning mellan en kolatom och en kväveatom, som presenterar den funktionella gruppen – C ≡ N. I nitriler är kvävet i slutet och kolet är fäst direkt i kolkedjan.

nitrilerna Även känd som cyanider, eftersom de härrör från reaktioner med cyanvätesyra (HCN).
de är ämnen giftigt för människor, eftersom de i kroppen kan bilda blåvätesyra i kontakt med magsyra, vilket förhindrar processer av cellandningen av cellerna.
I naturen kan nitriler finnas i vissa stenfrukter, men i en mycket låg koncentration, utan risk, och i bladen på vild kassava.

Iupac-regeln för nomenklaturen för nitriler definierar denna term nitril läggas till som ett suffix:

Se några exempel:
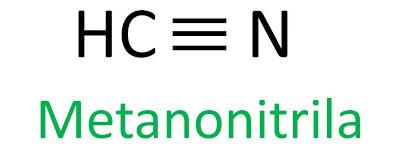 |
 |
Den vanliga formen av nomenklatur för nitriler är cyanid + radikalnamn.
isonitriler
Isonitriler, eller isonitriler, är föreningar som bildas av trippelbindning mellan en kolatom och en kväveatom, som presenterar den funktionella gruppen – R ≡ C. I isonitriler är kolet i slutet och kvävet är fäst direkt till kolkedjan.

Isonitrilerna skiljer sig från nitrilerna på grund av positionen för kväve- och kolatomerna, och I isonitriler karakteriseras kväve som en heteroatom., eftersom den är placerad mellan två kol.
De är instabila arter och kan omvandlas till nitriler vid förhöjda temperaturer. Isocyanidinsyrareaktioner ger upphov till isonitriler, varför dessa föreningar också är kända som isocyanider.
Isonitrilmolekyler följer Iupac-regeln för namngivning:
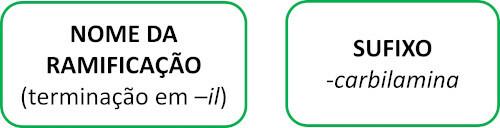
Se några exempel:
 |
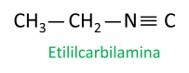 |
Tillämpningar av kvävefunktioner
Ämnen som hör till kvävefunktionerna har många användningsområden, främst inom industriområdet, för tillverkning av polymerer, gummi, syntetiska fibrer, läkemedel, jordbrukskemikalier, bekämpningsmedel och sprängämnen.
Till aminer används vid tillverkning av färgämnen, tvål, droger, i färd med gummivulkanisering, explosiva ämnen och andra industriella processer, och finns också i växter och bildas i processer för nedbrytning av organiskt material.

Till Amider har bred användning inom den industriella och kemiska sektorn, som ingår i produktionen av polymerer (som nylon och polyuretan), hartser, sprängämnen, gödningsmedel, insektsmedel, konstgödsel och droger.

Du nitroföreningarDess huvudsakliga tillämpning är tillverkning av sprängämnen. som används inom den militära, industriella och metallurgiska sektorn (för råvaruutvinning). En av de mest kända nitroföreningarna är trinitrotoluen, populärt känd som TNT. Andra tillämpningar av nitroföreningar är vid framställning av bekämpningsmedel, baktericider, färgämnen, petroleumraffinering, etc.

Till nitriler används som organiska lösningsmedel i laboratoriet och inom industrin, deltar i utvinnings- och tillverkningsprocesser av vissa syntetiska fibrer, plastpolymerer, färgämnen och gödningsmedel.

Till isonitriler används i olika processer för framställning av organiska föreningar, såsom lösningsmedel, och delta i tillverkningen av jordbrukskemikalier, bekämpningsmedel, gummi och plast.
Läs också:Halider — ämnen som har halogenatomer bundna till kolkedjan
Lösta övningar om kvävefunktioner
fråga 1
(FPS-PE-modifierad) Användningen av kvävehaltiga föreningar i syntetisk organisk kemi är mycket diversifierad och involverar framställning av läkemedel, färgämnen, sprängämnen och vitaminer. Titta på föreningarna nedan.
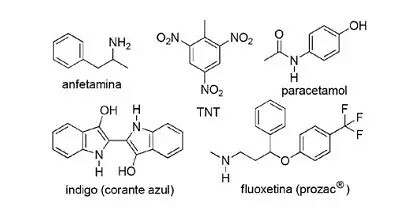
Om dessa föreningar, markera det felaktiga påståendet.
a) TNT är en nitroförening.
b) Den kvävehaltiga delen av fluoxetin är en sekundär amin.
c) Amfetamin klassificeras som en primär amid.
d) Indigo har heteroaromatiska ringar i sin struktur.
e) Den kvävehaltiga delen av paracetamol är en amid.
Upplösning:
Bokstaven C
Saken De är korrekt, eftersom TNT är en nitroförening eftersom den har INGA grupper2.
Saken B stämmer. Den kvävehaltiga delen av fluoxetin är en sekundär amin eftersom den är kopplad till två kolsegment.
Saken w är felaktigt, eftersom amfetamin klassas som en primär amin, inte en amid. Observera att den nuvarande gruppen är NH2. Så detta är kärnan i frågan.
Saken d är korrekt, eftersom indigo har heteroaromatiska ringar i sin struktur, det vill säga ringar som bildas av kolatomer och ett annat element - i det här fallet kväve.
Saken Det är är korrekt, eftersom paracetamol är en amid som innehåller kol kopplat till kväve och syre.
fråga 2
(UFMS) Yerba mate (Ilex paraguariensis), ursprungligen från Sydamerika, används som en stärkande och stimulerande dryck. Produkten som erhålls genom bearbetning av yerba mate-blad kan användas för att förbereda chimarrão och tereré, bland andra drycker som vanligtvis och kulturellt konsumeras i regioner i Argentina, Paraguay och Brasilien. Det stora intresset för yerba mate beror på de kemiska föreningarna som finns, på grund av dess antioxidant, stimulerande och urindrivande egenskaper.
(Tillgänglig i: http://repositorio.utfpr.edu.br/jspui/bitstream/1/3158/1/PG_PPGEP_Henrique%2C%20 Flavia%20Aparecida_2018.pdf. Tillträde den: 01 nov. 2018. Anpassad).
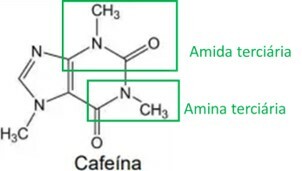
De stimulerande egenskaperna hos yerba mate är relaterade till dess innehåll av metylxantiner, en av de viktigaste är koffein, struktur presenterad nedan:

När man analyserar koffeins strukturformel är det korrekt att konstatera att det har följande organiska funktioner och egenskaper:
a) aldehyd och amid, basisk.
b) amin och amid, alkaliska.
c) amin och keton, alkaliska.
d) keton och amid, amfotera.
e) karboxylsyra och amin, basisk.
Upplösning:
Bokstaven B
Genom att analysera koffeinstrukturen identifieras amin- och amidfunktionella grupper, som markerats i bilden nedan. Eftersom dessa två grupper har en basisk eller alkalisk egenskap har koffein också denna egenskap, vilket innebär att vattenhaltiga koffeinlösningar har ett pH över 7.
Av Ana Luiza Lorenzen Lima
Kemilärare
Källa: Brasilien skola - https://brasilescola.uol.com.br/quimica/funcoes-nitrogenadas.htm
