DE Lagen om reaktionshastighet relaterar hastigheten för en kemisk transformation med koncentrationerna av reagens i kvantitet materia (mol / L), som kan anges enligt följande:

Tänk till exempel på följande generiska reaktion:
aA + bB → cC + dD
Låt oss säga att vi ökar koncentrationen av reaktanterna A och B, vad händer med reaktionshastigheten? Eftersom mängden reaktantpartiklar kommer att öka i samma utrymme kommer det att finnas mer effektiva kollisioner mellan dem, vilket kommer att resultera i en ökning av hastigheten för reaktionsutveckling. Vilket innebär att det kommer att öka din hastighet.
Därför är reaktionshastigheten direkt proportionell mot koncentrationen av reaktanter. Det beror dock också på temperaturen. Därför har vi följande matematiska ekvation som representerar lagen om reaktionshastighet:

På vad:
v = reaktionshastighet;
k = konstant som bara beror på temperaturvärdet;
α och β = exponenter bestämda experimentellt.
Endast när reaktionen är elementär, det vill säga den sker i ett enda steg, är exponenterna exakt lika med koefficienterna för den balanserade kemiska ekvationen:
v = k. [DE]De. [B]B. I andra fall måste dock den lämpliga styrkan till vilken koncentrationen av varje reagens måste höjas bestämmas experimentellt.Lagen om reaktionshastighet har många namn, här är några: Law of Mass Action, Equation of Rapidity, Kinetic Reaction Law och Guldberg-Waage Law.
Tänk på ett exempel på hur du tillämpar denna lag:
Tänk på följande elementära reaktion:
2 HCl (g) → H2 (g) + Cl2 (g)
a) Skriv ekvationen för reaktionens hastighet;
b) Genom experiment noterades hastigheten för denna vätekloridgasnedbrytningsreaktion och koncentrationen av detta reagens vid en konstant temperatur av 25 ° C i tabellen nedan:
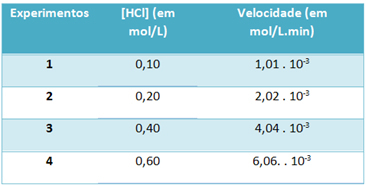
Basera på detta, bestäm den karakteristiska hastighetskonstanten för denna reaktion vid nämnda temperatur.
Upplösning:
De) v = k. [HCl]2
b) v = k. [HCl]2
k = __v___
[HCl]2
k = 1,01. 10-3 mol. L-1. min-1
0,01 mol. L-1
k = 1,01. 10-1 min-1
För att lösa bokstaven "b" kan du använda data från valfritt experiment att det erhållna värdet kommer att vara detsamma.
Men tänk om reaktionen inte är elementär? Hur kommer det att vara möjligt att lösa frågor som dessa i icke-elementära reaktioner? För att ta reda på hur, läs hastighetslagen för icke-elementära reaktioner.
Av Jennifer Fogaça
Examen i kemi
Källa: Brazil School - https://brasilescola.uol.com.br/quimica/lei-velocidade-das-reacoes-quimicas.htm
