Den huvudsakliga utmärkande egenskapen för redoxreaktioner är att samtidigt en kemisk art förlorar elektroner (genom att oxidera) och en annan får elektroner (genom att reducera).
I vissa reaktioner är det emellertid möjligt att observera att det inte bara sker en oxidation och/eller reduktion. Nedan följer ett exempel:
SnS + HCl + HNO3 → SnCl4 + S + NO + H2O
Genom att beräkna oxidationstalen (Nox) för alla atomer i denna reaktion, som lärs ut i texten "Bestämning av oxidationstalet (Nox)", har vi:
+2 -2 +1 -1 +1 +5 -2 +4 -1 0 +2 -2 +1 -2
SnS + HCl + HNO3 → SnCl4 + S + NO + H2O
Låt oss kolla nu vilkaämnen uppvisade variationer i deras Nox och, följaktligen, som oxiderade och reducerade:
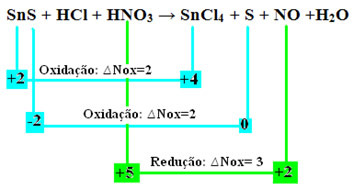
Observera att två oxidationer har inträffat. Så, i så fall, hur ska man balansera den kemiska ekvationen?
En viktig sak att tänka på som gäller för alla redoxreaktioner är att antalet elektroner som ges bort måste alltid vara lika med antalet mottagna elektroner.
För att balansera denna typ av reaktion, följ därför samma regler som anges i texten "
Redox balansering” dock med bara en förändring: bestämningen av Nox-variationen (∆Nox) för arten som genererade de två oxidationerna (SnS) kommer att vara summan av de två ∆Nox, vilket ger oss det totala värdet av förlorade elektroner:- SnS: ∆Total Nox = (∆Nox SnCl4) + (∆Nox S)
SnS: ∆Total NOx = 2 + 2 = 4
- HNO3: ∆Nox = 3
Så vi kan fortsätta med följande steg för att balansera:
Sluta inte nu... Det kommer mer efter reklam ;)
- SnS: ∆Totalt NOx = 4 → 4 kommer att vara HNO-koefficienten3;
- HNO3: ∆Nox = 3 → 3 kommer att vara koefficienten för SnS.
3 SnS + HCl+ 4 HNO3 → SnCl4 + S + NO + H2O
Fortsätter balanseringen genom testmetoden:
- Eftersom du har 3 Sn och 3 S i den 1:a medlemmen, kommer dessa också att vara dina koefficienter i den andra medlemmen:
3 SnS + HCl + 4 HNO3 → 3 SnCl4 + 3 Y+NEJ+H2O
- Med det lämnades den andra medlemmen med 12 Cl (3. 4 = 12), så 12 kommer att vara koefficienten för ämnet där Cl finns i den första medlemmen, som är HCl:
3 SnS+ 12 HCl + 4 HNO3 → 3 SnCl4 + 3S + NO +H2O
- Vi har nu 16 H i den första medlemmen (12 + 4 = 16), därav koefficienten för H2O kommer att vara lika med 8, eftersom 8 multiplicerat med väteindexet, vilket är 2, ger 16:
3 SnS + 12 HCl + 4 HNO3 → 3 SnCl4 + 3 S + NO +8H2O
- Dessutom, i den 1:a medlemmen finns det också 4 N, så 4 kommer också att vara koefficienten för N i den andra medlemmen:
3 SnS + 12 HCl + 4 HNO3 → 3 SnCl4 + 3 S + 4 NO +8 H2O
Observera att mängden syre i den första extremiteten (3. 4 = 12) är lika med den totala mängden av det elementet i den andra delen (4 + 8 = 12). Så reaktionen är balanserad.
Av Jennifer Fogaça
Examen i kemi
Vill du referera till den här texten i ett skol- eller akademiskt arbete? Se:
FOGAÇA, Jennifer Rocha Vargas. "Reaktioner med mer än en oxidation och/eller reduktion"; Brasilien skola. Tillgänglig i: https://brasilescola.uol.com.br/quimica/reacoes-com-mais-uma-oxidacao-ou-reducao.htm. Åtkom den 27 juli 2021.


