DE entalpi är en termodynamisk funktion genom vilken beräknar värmen som är involverad i isobariska processerdet vill säga som hålls under konstant press. Dess utveckling ägde rum kort efter fallet av kaloriteorin, med framsteg av termodynamik mellan åren 1840 och 1850.
Entalpin, för Vadumica, har inte så stor betydelse om det bearbetas som ett absolut och isolerat värde, men det gör det när man överväger variation av dess värde i en kemisk process. Det finns flera sätt att beräkna entalpivariationen för en process, de viktigaste är genom energierna för bildning, bindning och även genom därhej från hess.
Läs också: Vad är Gibbs Free Energy?
Entalpi sammanfattning
Entalpi är ett termodynamiskt verktyg för att beräkna värmen som är involverad i processer som sker vid konstant tryck.
Det definierades av den amerikanske fysikern Josiah W. Gibbs, i samband med kaloriteorins fall.
Inom kemi använder vi alltid entalpiändringen, representerad som ΔH.
Kemiska reaktioner som absorberar värme kallas endotermiska och har ΔH > 0.
Kemiska reaktioner som frigör värme kallas exotermiska och har ΔH < 0.
Videolektion om entalpi
Vad är entalpi?
Entalpin, alltid representerad av H, var initialt definieras av den amerikanske fysikern Josiah Willard Gibbs, som han kallade värmen vid konstant tryck funktion, eftersom, med hans ord:
"[...] funktionsminskningen representerar, i alla fall där trycket inte varierar, den värme som avges av systemet."
Sluta inte nu... Det kommer mer efter reklam ;)
Från Gibbs arbete kan vi alltså förstå entalpi som en termodynamisk funktion vars variation är numeriskt lika med mängden värme som växlas i systemet, till tryck konstant. Detta betyder att, i isobariska processer (som de flesta kemiska processer), att veta beräkna variationen av entalpifunktionen kan man då veta värdet på värmeutbyte mellan system och grannskap.

En sådan korrelation med värme orsakar många elever tror felaktigt att entalpi är synonymt med värme eller något som energiinnehåll, värmeinnehåll, frigjord värme och absorberad värme och liknande.
Entalpin uppstod i samband med kollapsen av kaloriteorin, som behandlade värme som ett obotligt materialämne som överfördes från varmare kroppar till kallare kroppar. Det fanns alltså ett behov av att ha ett nytt verktyg för att beräkna värme. Lösningen var alltså att använda kvantiteter som redan hade definierade termodynamiska ekvationer, såsom entalpi.
Läs också: Hur beräknar man lösningens entalpiförändring?
entalpivariation
Eftersom entalpi är ett verktyg som används för att beräkna värmeutbytet i en kemisk process, är det ingen mening att använda det som ett absolut, isolerat tal, men med tanke på dess variation, det vill säga i praktiken, bör vi bara bedöma hur mycket, numeriskt, entalpin förändrades under den kemiska processen, eftersom termodynamiken försäkrar oss att dess variation är numeriskt lika med den värme som frigörs eller absorberas i processen.
Strängt taget kan vi definiera entalpivariationen som:
ΔH = HSlutlig - Hförsta
Liksom i kemiska processer kan det sista steget betraktas som produkterna och det inledande steget kan betraktas som reagenserna. Det är också vanligt att se definitionen av entalpivariation som:
ΔH = HProdukter - Hreagenser
Ur en praktisk och tolkningsmässig synvinkel, om entalpiförändringen är positiv (AH> 0), säger vi att den kemiska reaktionen är endotermiskdet vill säga det finns värmeabsorption under hela processen. Redan om entalpiförändringen är negativ (ΔH< 0), säger vi att den kemiska reaktionen är exotermiskdet vill säga värme frigörs under hela processen.
Entalpivariationen, i många fall, observeras i grafer, som visas i följande exempel.
Exempel 1:
Endotermisk reaktionsdiagram
I entalpigraferna för endotermiska reaktioner kan man se att mängden entalpi för produkterna är större än för reaktanterna, vilket indikerar att variationen längs reaktionen är positiv. Således, om ΔH > 0, kan vi säga att den kemiska processen inträffade med värmeabsorption.
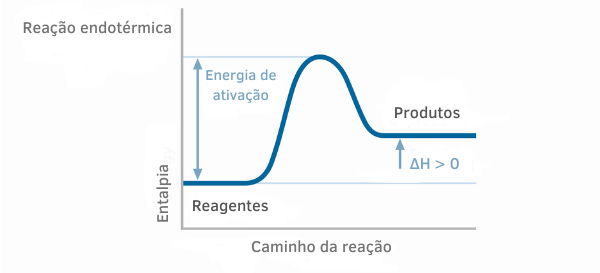
Exempel 2:
Exotermisk reaktionsdiagram:
I entalpigraferna för exoterma reaktioner kan man se att mängden entalpi för produkterna är mindre än reaktanternas, vilket indikerar att variationen längs reaktionen är negativ. Således, eftersom ΔH < 0, kan vi säga att den kemiska processen inträffade med frigöring av värme.
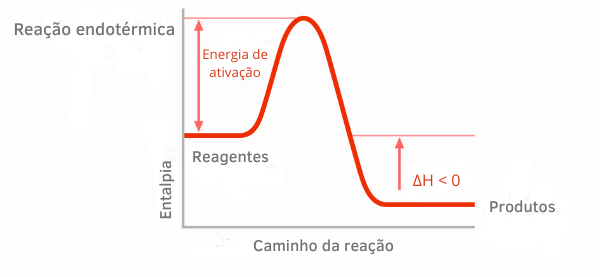
Läs mer om dessa klassificeringar av kemiska reaktioner i texten: FÖRendotermiska och exoterma processer.
Typer av entalpi
bildningsentalpi
DE bildningsentalpi é beräknad baserat på kemiska reaktioner bildas, som är reaktioner där en mol sammansatta ämnen bildas av deras mest stabila enkla ämnen vid rumstemperatur och 1 atmosfärs tryck.
H2(g) + ½ O2 (g) → H2O (l) H°f = -286 kJ/mol
Den stora fördelen med bildningsentalpin är att enkla ämnen som är mer stabila vid rumstemperatur och 1 atmosfärs tryck har en entalpi som överensstämmer med noll. Därmed inte sagt att de faktiskt är noll, men för förenkling och bättre klassificering behandlas de så här.
Varelse H = HProdukter - Hreagenser, om vi anser att Hreagenser = 0, kan vi säga att det observerade värdet av ΔH endast är relaterat till produkterna, som i dessa fall alltid är en mol av den sammansatta substansen. Därför anger vi detta värde som standardentalpivariationen för vattenbildning, representerad av ΔH°f.
Det var med denna metod som flera ämnen hade sina varianter av standard entalpi formationstabeller, som vi kan se nedan.
Ämne |
Formationsentalpi (ΔH°fi kJ/mol |
CO2 (g) |
-393,4 |
CaO(s) |
-634,9 |
Hej g) |
+25,9 |
NEJ (g) |
+90,1 |
bindande entalpi
Bindningsentalpin tjänar till att indikera mängden energi som är involverad i bristningen eller bildningen av en given mullvad. kemisk bindning.
Det är underförstått att, för att bryta en kemisk bindning är det nödvändigt att absorbera värme, så att bindningsatomerna ökar sina inre energi och, följaktligen, öka din kinetiska energi. med större rörelseenergi, vibrerar atomerna mer intensivt, vilket gör att bindningarna bryts. Således är varje bindningsbrytning en endoterm process.
Annars, för att bilda en kemisk bindning, förlorar atomer rörelsefriheten och behöver minska sin rörelsegrad, vilket minskar deras kinetiska energi. Reservenergin frigörs sedan i form av värme. Således, all bindningsbildning är en exoterm process.
Tabellen nedan visar värden på energierna associerade med varje kemisk bindning.
Förbindelse |
Bindningsenergi (kJ/mol) |
C-H |
412,9 |
C-C |
347,8 |
O═O |
497,8 |
F-F |
154,6 |
NEJ |
943,8 |
Observera att det inte finns några tecken i värdena, eftersom de är i modul. Detta beror på att signalen måste tilldelas av dig beroende på om länken är bruten eller bildad.
Förbränningsentalpi
DE förbränningsentalpi tjänar till att ange mängd värme som frigörs vid förbränning av en mol av ett ämne. Det bör noteras att varje förbränningsreaktion är exoterm, eftersom varje förbränning avger värme.
CH4 (g) + 2 O2 (g) → CO2 (g) + 2 H2ΔH°Ç = -889,5 kJ/mol
Tabellen nedan visar förbränningsentalpivärden för vissa kemiska ämnen.
Ämne |
Förbränningsentalpi (ΔH°Çi kJ/mol |
Etanol - C2H5ÅH (1) |
-1368 |
Bensen - C6H6 (1) |
-3268 |
Oktan - C8H18 (1) |
-5471 |
Glukos - C6H12O6 (s) |
-2808 |
Entalpi av fysisk tillståndsförändring
Varje förändring i fysiskt tillstånd innebär värmeväxling. Därför entalpi för förändring av fysiskt tillstånd tjänar till att ange mängd värme involverad i fysiska tillståndsförändringsprocesser.
Till exempel har vi vattenförångning:
H2O (1) → H2O (g) AH = +44 kJ/mol
Vid smältning av vatten har vi:
H2O(s) → H2O (1) AH = +7,3 kJ/mol
Entalpivärden är symmetriska för omvända processer, vilket innebär att till exempel entalpiförändringen i flytande av vatten är -44 kJ/mol, medan den vid stelning är lika med -7,3 kJ/mol.
Läs också: Vad är entropi?
Lösta övningar om entalpi
Fråga 1 - (UERJ 2018) Föroreningskapaciteten hos ett kolväte som används som bränsle bestäms av förhållandet mellan den energi som frigörs och mängden CO2 bildas i dess fullständiga förbränning. Ju högre förhållande, desto lägre föroreningskapacitet. Tabellen nedan visar standardentalpin för förbränning av fyra kolväten.

Från tabellen är kolvätet med den lägsta förorenande kapaciteten:
Oktan
Hexan
Bensen
pentan
Upplösning
Alternativ D
Frågan indikerar att föroreningskapaciteten definieras som förhållandet (kvoten) mellan den energi som frigörs och mängden CO2 bildas i dess fullständiga förbränning. Ju större anledning, ju lägre föroreningskapacitet, det vill säga mer energi frigörs per mol CO2 genererad.
De fullständiga förbränningsreaktionerna av Kolväten citerade är:
Oktan: Ç8H18 +25/2 O2 → 8 CO2 + 9 timmar2Anledningen: 5440/8 = 680
Hexan: Ç6H14 +19/2 O2 → 6 CO2 + 7 timmar2Anledningen: 4140/6 = 690
Bensen: Ç6H6 + 15/2 O2 → 6 CO2 + 3 H2Anledningen: 3270/6 = 545
pentan: Ç5H12 + 8 O2 → 5 CO2 + 6 H2Anledningen: 3510/5 = 702
Således kan vi dra slutsatsen att pentan är det kolväte som har den lägsta föroreningskapaciteten.
Fråga 2 - (Enem 2015) Användningen av skogsrester blir mer attraktiv för varje dag, eftersom de är en förnybar energikälla. Figuren representerar förbränningen av en bioolja utvunnen ur träavfall, där ΔH1 entalpivariationen på grund av förbränning av 1 g av denna bioolja, vilket resulterar i koldioxid och flytande vatten, och ΔH2 den entalpiförändring som är involverad i omvandlingen av 1 g vatten i gasformigt tillstånd till flytande.

Entalpivariationen, i kJ, för förbränning av 5 g av denna bioolja, vilket resulterar i CO2 (gasformig) och H2Den (gasformiga) är:
A) -106
B) -94
C) -82
D) -21,2
E) -16,4
Upplösning
Alternativ C
Från den visade grafen har vi ΔH1 som entalpivariationen av biooljebränning som producerar CO2 (g) och H2O (1) och AH2 som entalpiförändringen av vatten flytande, eftersom CO2 förblir gasformig och endast det fysiska tillståndet Vatten förändringar (från gas till vätska).
Övningen frågar efter entalpiförändringen av att bränna 5 g bioolja, vilket resulterar i CO2 (gasformig) och H2O (gasformig). Från diagrammet kan denna entalpiförändring definieras som ΔH = ΔH1 – H2. Således kommer värdet på AH att vara lika med -16,4 kJ/g. Denna variation, som vi kan se i enheten, är för VARJE gram bioolja. För 5 gram måste vi göra andel:
1 g bioolja -16,4 kJ
5 g bioolja x
1. x = 5. (-16,4)
x = -82 kJ
Vi kan då markera alternativ C.
Av Stéfano Araújo Novais
Kemilärare
