Organiska föreningar kan representeras på en mängd olika sätt, såsom en platt strukturformel, en förenklad eller kondenserad strukturformel eller en streckformel. Den enklaste representationen är dock via molekylformeln.

Låt oss därför se hur man bestämmer molekylformeln för organiska föreningar, baserat på de andra formlerna som nämns ovan.
1. Genom den platta strukturformeln:denna formel visar arrangemanget eller arrangemanget av atomer i molekylen. Till exempel nedan är den platta strukturformeln för ett av kolvätena som finns i bensin.

Observera att i denna formel visas alla atomer och alla befintliga bindningar mellan dem. Nu, för att bestämma molekylformeln för denna förening, räkna bara antalet atomer i varje grundämne och placera ett index på den nedre högra sidan av grundämnet i fråga.
En viktig aspekt att lyfta fram är det vi börjar alltid molekylformeln för organiska föreningar från grundämnet kol, eftersom det är huvudbeståndsdelen i dessa ämnen. Se exemplet:
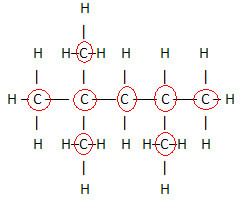
Eftersom det finns 8 kol, börjar vi skriva molekylformeln så här: Ç8
För att slutföra denna formel räknar vi mängden väte:
därför din molekylär formel é Ç8H18.
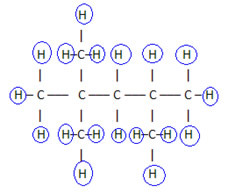
2. Genom den förenklade eller kondenserade strukturformeln: i denna typ av formel förkortas mängden väte. Titta till exempel på samma formel för molekylen som finns i bensin, nu i en kondenserad form:
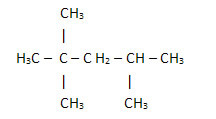
På så sätt är det ännu lättare att räkna mängden väte, lägg bara till indexen (3 +3+ 3 +2 +1 +3 +3 = 18).
Men låt oss nu titta på den kondenserade strukturformeln för linolsyra, som finns i grönsaker som bomull, sojabönor, solrosor, etc. och som används i färger och lacker:
H3C─CH2CH2CH2CH2CH═CH─CH2CH═CH─CH2CH2CH2CH2CH2CH2CH2─COOH
Om vi räknar mängden kol, väte och syre har vi följande molekylär formel linolsyra: Ç18H32O2.
3. Genom slagformeln: denna formel förenklar ytterligare hur man representerar organiska föreningar, eftersom den utelämnar grupperna C, CH, CH2 och CH3.
Ett exempel är linolmolekylen, se hur den ser ut:

Låt oss först räkna mängden kol, och kom ihåg att i den här formeln representeras varje bindning mellan kol med ett streck. Således motsvarar spetsarna, såväl som de två böjningspunkterna, kolatomer.
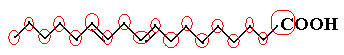
Så vi har: Ç18
Nu, för att räkna mängden väte, måste vi komma ihåg att bindningarna mellan kol och väte är underförstådda, eftersom kol är känt för att göra fyra bindningar; sålunda är mängden bindningar som saknas mängden väte bunden till det elementet.
Se förklaringarna nedan:
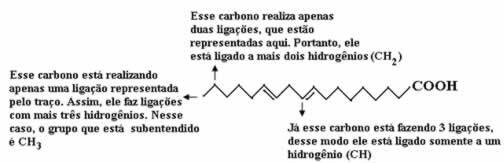
Således kommer mängden väte att vara: 32.

Mängden syre är ganska enkel att räkna, eftersom det bara finns två. Sedan molekylär formel é: Ç18H32O2.
Av Jennifer Fogaça
Examen i kemi
Källa: Brasilien skola - https://brasilescola.uol.com.br/quimica/formulas-moleculares-compostos-organicos.htm
