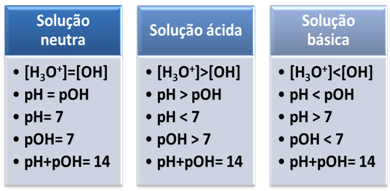
Ett medium anses vara neutralt om det har samma koncentration, i mol/L, av hydroniumjonerna (H3O+) och hydroxid (OH-).
Ett exempel på ett neutralt medium som till och med fungerar som standard för andra lösningar är rent, destillerat vatten vid en temperatur på 25ºC. Vid denna temperatur har den exakt 1. 10-7 mol/L av båda jonerna. Därför kan din joniska produkt (Kw) är lika med 10-14 (mol/L)2:
Kw = [H3O+]. [åh-]
Kw = (1. 10-7 mol/L). (1. 10-7 mol/L) = 10-14 (mol/L)2
pH och pOH anges nedan:
pH= - log [H3O+] pOH= -log[OH-]
pH= - log 1. 10-7 pOH= - log 1. 10-7
pH = 7pOH = 7
Detta visar oss att i en neutral lösning pH är lika med pOH.
- Syra medium:
I ett surt medium, koncentrationen av H-joner3O+ är större än för OH-joner-.
En sådan lösning kan uppnås genom att tillsätta en liten del av H-jonerna3O+t.ex. med hjälp av en syra.
Enligt Le Chateliers princip, när en störning orsakas av ett system i jämvikt, tenderar det att återställa sig själv för att minska effekterna av denna kraft. Det betyder att om en syra tillsätts vatten kommer H-jonerna
3O+ de kommer att vara i överskott och balansen kommer att förskjutas i omvänd reaktionsriktning, till vänster. Så dessa överskott av joner kommer att reagera med OH-jonerna-. Således koncentrationen av OH-joner- kommer att minska och lösningen blir sur.
Den joniska produkten (Kw) är alltid lika med 10-14, men koncentrationen av H-joner3O+ är större än koncentrationen av OH-joner-1. Därför är pH-värdet högre än pOH i ett surt medium, men summan är alltid lika med 14.
Dessutom, desto högre koncentration av H-joner3O+, desto högre pH-värde. Vid rumstemperatur (25°C), pH < 7 och pOH > 7.

- Grundläggande medel:
I det grundläggande mediet, koncentrationen av OH-joner- är större än H-jonerna3O+.
Om vi lägger till en bas till vatten betyder det att vi lägger till OH-joner.- och, som förklarats i föregående punkt, enligt Le Chateliers princip, jämvikten i reaktionen hos självjonisering av vatten kommer att röra sig i motsatt riktning, med överskott av joner som reagerar med H joner3O+, minska din koncentration och göra lösningen grundläggande.
I så fall kommer pOH att vara högre än pH. Vid rumstemperatur (25°C), pH > 7 och pOH < 7.

I korthet:
Av Jennifer Fogaça
Examen i kemi


