Det periodiska systemet är ett viktigt studieverktyg som samlar information om alla kända kemiska element.
Testa dina kunskaper med den här listan över 17 frågor med de olika tillvägagångssätten i ämnet och lösa dina tvivel med de resolutioner som kommenteras efter feedbacken.
För att förstå frågorna, använd periodiska systemet komplett och uppdaterad.
Organisation av periodiska system
fråga 1
(UFU) I början av 1800-talet, med upptäckten och isoleringen av flera kemiska grundämnen, blev det nödvändigt att klassificera dem rationellt för att genomföra systematiska studier. Många bidrag tillkom tills den nuvarande periodiska klassificeringen av kemiska grundämnen nåddes. När det gäller den aktuella periodiska klassificeringen, svara:
a) Hur listas elementen sekventiellt i det periodiska systemet?
Det periodiska systemet är organiserat i sekvenser av kemiska element i stigande ordning atomnummer. Detta antal motsvarar antalet protoner i atomens kärna.
Denna organisationsmetod föreslogs av Henry Moseley när han konfigurerade om bordet av Dmitri Mendeleiev.
Ett element kan placeras i tabellen efter familjen och under vilken perioden det infogas. Denna fördelning sker enligt följande:
| grupper eller familjer | 18 vertikala sekvenser |
| Grupper av element som har liknande egenskaper. |
| Perioder | 7 horisontella sekvenser |
| Antal elektroniska lager som elementet har. |
b) Vilka grupper i det periodiska systemet finns: en halogen, en alkalimetall, en jordalkalimetall, en kalkogen och en ädelgas?
Klassificeringen av element i grupper görs enligt egenskaper. Element som ingår i samma grupp har liknande egenskaper och för klassificeringarna måste vi:
| Klassificering | Grupp | Familj | Element |
| halogen | 17 | 7A | F, Cl, Br, I, At och Ts |
| alkalimetall | 1 | 1A | Li, Na, K, Rb, Cs och Fr |
| jordalkalimetall | 2 | 2A | Var, Mg, Ca, Sr, Ba och Ra |
| kalkogen | 16 | 6A | O, S, Se, Te, Po och Lv |
| ädelgas | 18 | 8A | Han, Ne, Ar, Kr, Xe, Rn och Og |
fråga 2
(PUC-SP) Lös problemet baserat på analysen av uttalandena nedan.
I - Det nuvarande moderna periodiska systemet är ordnat i stigande ordning av atommassan.
II - Alla element som har 1 elektron och 2 elektroner i valensskalet är, respektive alkalimetaller och jordalkalimetaller, förutsatt att huvudkvantantalet av detta lager (n 1).
III - Under samma period presenterar elementen samma antal nivåer (lager).
IV - I samma grupp (familj) har elementen samma antal nivåer (lager).
Det dras slutsatsen att, med avseende på den nuvarande periodiska tabellen över kemiska element, är de korrekta:
a) I och IV (endast).
b) I och II (endast).
c) II och III (endast).
d) II och IV (endast).
e) III och IV (endast).
Rätt alternativ: c) II och III (endast).
När vi analyserar varje alternativ måste vi:
JAG FEL. Elementen är ordnade i stigande ordning med atomnummer.
II - KORREKT. Elektronerna i valensskalet definierar den grupp elementet är beläget i.
| alkaliska metaller | 1 elektron i valensskalet |
| 3läsa | 2-1 |
| 11På | 2-8-1 |
| 19K | 2-8-8-1 |
| 37Rb | 2-8-18-8-1 |
| 55Cs | 2-8-18-18-8-1 |
| 87Fr | 2-8-18-32-18-8-1 |
| alkaliska jordartsmetaller | 2 elektroner i valensskalet |
| 4vara | 2-2 |
| 12mg | 2-8-2 |
| 20Här | 2-8-8-2 |
| 38herr | 2-8-18-8-2 |
| 56Ba | 2-8-18-18-8-2 |
| 88Groda | 2-8-18-32-18-8-2 |
Huvudkvantantalet motsvarar skalet i vilket elektronen är belägen och skiljer sig från 1 pga genom den elektroniska distributionen märker vi att elektronens placering är från det andra skalet eller n = 2.
III - KORREKT. Placeringen av ett element under en viss period beror på antalet lager när den elektroniska distributionen görs.
| Perioder | 7 horisontella sekvenser |
| 1: a perioden | 1 lager: K |
| 2: a perioden | 2 lager: K, L. |
| 3: e perioden | 3 lager: K, L, M |
| 4: e perioden | 4 lager: K, L, M, N |
| 5: e perioden | 5 lager: K, L, M, N, O |
| 6: e perioden | 6 lager: K, L, M, N, O, P |
| 7: e perioden | 7 lager: K, L, M, N, O, P, Q |
Exempel: kemiska grundämnet som ligger under andra perioden.
IV - FEL. Element som tillhör samma grupp har liknande egenskaper och detta beror på att de har samma antal elektroner i valensskalet.
Exempel:
| Beryllium | Magnesium |
|
2 elektroner i valenslager. |
2 elektroner i valenslager. |
Därför ingår beryllium och magnesium i grupp 2 i det periodiska systemet.
fråga 3
(Unitins) Angående den moderna periodiska klassificeringen av element, identifiera det sanna uttalandet:
a) i en familj har elementen i allmänhet samma antal elektroner i det sista skalet.
b) I det periodiska systemet placeras de kemiska elementen i fallande ordning av atommassorna.
c) i en familj har elementen mycket olika kemiska egenskaper.
d) under en period har elementen liknande kemiska egenskaper.
e) alla representativa element tillhör grupp B i det periodiska systemet.
Rätt alternativ: a) i en familj har elementen i allmänhet samma antal elektroner i det sista skalet.
a) KORREKT. Kemiska element i samma familj har samma antal elektroner i det sista skalet och detta gör att de har liknande egenskaper.
b) FEL. Atommassorna ökar när grundämnets atomnummer ökar.
c) FEL. Elementens kemiska egenskaper är likartade, så de är grupperade i samma familj.
d) FEL. Vid en tidpunkt har elementen sina elektroner fördelade i samma antal skal.
e) FEL. De representativa elementen tillhör grupp A, vilket motsvarar familjerna: 1A, 2A, 3A, 4A, 5A, 6A, 7A och 8A. Element som tillhör grupp B är övergångselement.
fråga 4
(Vunesp) Med tanke på egenskaperna hos kemiska grundämnen och det periodiska systemet är det fel att ange:
a) en metall är ett ämne som leder elektrisk ström, är duktilt och formbart.
b) en icke-metall är ett ämne som inte leder elektrisk ström, varken är duktilt eller formbart.
c) en halvmetall har det fysiska utseendet på en metall, men kemiskt beteende som liknar en icke-metall.
d) de flesta kemiska element består av icke-metaller.
e) ädelgaserna är monoatomiska.
Felaktigt alternativ: d) de flesta kemiska element är icke-metaller.
Observera klassificeringen av kemiska element i det periodiska systemet i metaller, icke-metaller och halvmetaller.

Som vi kan se är de flesta elementen metaller.
a) KORREKT. Metaller leder elektricitet på grund av elektronmoln bildade av fria elektroner, som är karakteristiska för deras struktur. De är duktila eftersom de kan förvandlas till ledningar eller ark, beroende på det område där trycket appliceras. De är också formbara, eftersom mycket tunna ark kan produceras med denna typ av material.
b) KORREKT. Icke-metaller har motsatta egenskaper hos metaller. Istället för ledare är de bra värmeisolatorer och, eftersom de är spröda, är de inte gjutna till trådar eller ark eftersom de inte har god smidighet och smidighet.
c) KORREKT. Halvmetaller har egenskaper mellan metaller och icke-metaller. Eftersom de är halvledare av elektricitet har de en metallisk glans men är spröda som icke-metaller.
d) FEL. De flesta grundämnen klassificeras som metaller. Klasserna av metaller som finns i det periodiska systemet är: alkaliska, jordalkaliska, övergångsinterna och externa.
e) KORREKT. Ädelgaser är monoatomiska, så de representeras endast av sina initialer.
Exempel:
| ädelgas | kalkogen |
| Helium (He) | Syre (O2) |
| monoatomisk: bildad av en atom | diatomisk: bildad av två atomer |
På grund av ädelgasens stabilitet har elementen i denna familj låg reaktivitet och är också kända som inerta.
fråga 5
Om organisationen av det nuvarande periodiska systemet, svar:
a) Vad är kolumner?
b) Vad är linjerna?
c) Vad är metoden för att organisera de kemiska elementen?
Svar:
a) kolumnerna är grupperna i det periodiska systemet, tidigare kallade familjer, som sammanför kemiska element med liknande egenskaper.
b) Linjerna är perioderna i det periodiska systemet och anger antalet elektroniska lager av en atom i marktillståndet.
c) De kemiska elementen i det nuvarande periodiska systemet är ordnade i stigande ordning av atomnummer, vilket anger antalet protoner i atomens kärna.
Familjer med periodiskt system
fråga 1
(CESGRANRIO) Att göra kopplingen mellan kolumnerna nedan, som motsvarar elementfamiljerna enligt det periodiska systemet, kommer den numeriska sekvensen att vara:
| 1. ädelgaser | • Grupp 1A |
| 2. alkaliska metaller | • Grupp 2A |
| 3. alkaliska jordartsmetaller | • Grupp 6A |
| 4. Chalcogens | • Grupp 7A |
| 5. Halogener | • Grupp 0 |
a) 1, 2, 3, 4, 5.
b) 2, 3, 4, 5, 1.
c) 3, 2, 5, 4, 1.
d) 3, 2, 4, 5, 1.
e) 5, 2, 4, 3, 1.
Rätt alternativ: b) 2, 3, 4, 5, 1.
| grupper | elektronisk konfiguration |
| • Grupp 1A: 2. alkaliska metaller | oss1 (med n |
| • Grupp 2A: 3. alkaliska jordartsmetaller | oss2 (med n |
| • Grupp 6A: 4. Chalcogens | oss2np4 |
| • Grupp 7A: 5. Halogener | oss2np5 |
| • Grupp 0: 1. ädelgaser | 1s2 (Han) eller oss2np6 (om n> 1) |
fråga 2
(UECE) Det kemiska elementet med Z = 54 har i sitt valenslager 5s-konfigurationen2 5p6. Elementen med Z = 52 och med Z = 56 tillhör familjerna till:
a) kalkogener och jordalkalier
b) halogener och alkalier
c) halogener och jordalkalier
d) kalkogener och alkalier
Rätt alternativ: a) kalkogener och jordalkalier.
Med tanke på atomnumren utförde vi den elektroniska distributionen och hittade följande resultat:
| 54X och | 52Du | 56Ba |
|
8 elektroner i valenslager |
6 elektroner i valenslager |
2 elektroner i valenslager |
| Ädla gaser: 8A-familj | Chalcogens: 6A familj | Alkaline Earth: familj 2A |
fråga 3
(F. Ibero-Americana-SP) Den periodiska systemgruppen som kännetecknas av övervägande av artificiella element är följande:
a) lantanider
b) ädelgaser
c) övergångsmetaller
d) jordalkalimetaller
e) aktinider
Rätt alternativ: e) aktinider.
Konstgjorda element är de som inte finns i naturen och som har syntetiserats i laboratoriet genom kärnreaktioner.
De kallas också transuraniska element, eftersom dessa radioaktiva element har ett atomnummer större än 92, vilket motsvarar uran.
I allmänhet är dessa element kortlivade och varar upp till bråkdelar av en sekund.
Enligt denna information måste vi:
Elementen som finns i naturen är: lantanider, ädelgaser, övergångsmetaller och jordalkalimetaller. Med undantag av teknetium och prometium, som är konstgjorda.
Övervägande av artificiella element är aktinider, klassificerade som interna övergångsmetaller och införda i det periodiska systemet nedanför lantaniderna. Från den serien är endast aktinium, torium, protaktinium och uran naturliga.
fråga 4
(U. Katolska kyrkan i Salvador-BA) X-arten2- med 8 elektroner i det yttersta skalet (valensskal) kan det vara från element X, som i det periodiska systemet tillhör gruppen:
a) 7A
b) 6A
c) 2A
d) 1A
e) 8A
Rätt alternativ: b) 6A.
Enligt oktettregeln, för att ett element ska få stabilitet, antar det den elektroniska konfigurationen av en ädelgas, som har 8 elektroner i valensskalet.
Avgift 2- på art X2- indikerar att elementet har fått 2 elektroner.
Elektronkonfigurationen för arten som har 8 elektroner i det yttersta skalet är ns2np6.
Efter att ha förlorat två elektroner återgår elementet till sitt jordtillstånd med ns-elektronkonfiguration2np4.
De 6 elektronerna i valensskalet är karaktäristiska för kalkogener, element i 6A-familjen.
Till exempel:
| Element: syre | elektronisk konfiguration |
| 8O | 1s22s22p4 |
| art O2- | 1s22s22p6 |
Lära sig mer om Familjer med periodiskt system.
Kemiska element
fråga 1
(CESGRANRIO) Med tanke på elementen i atomnummer 3, 9, 11, 12, 20, 37, 38, 47, 55, 56 och 75 är alternativet som endast innehåller alkalimetaller:
a) 3, 11, 37 och 55
b) 3, 9, 37 och 55
c) 9, 11, 38 och 55
d) 12, 20, 38 och 56
e) 12, 37, 47 och 75
Rätt alternativ: a) 3, 11, 37 och 55
Alkalimetaller motsvarar de kemiska grundämnena som avslutar den elektroniska distributionen med en elektron i undernivån.
Genom att göra den elektroniska fördelningen av de angivna atomnumren har vi följande alkalimetaller:
| Z = 3 | Z = 11 | Z = 37 | Z = 55 |
| Litium | Natrium | Rubidium | Cesium |
De andra atomnumren motsvarar element i följande grupper:
Jordalkalimetaller: avsluta elektronisk distribution vid undernivåer2.
| Z = 12 | Z = 38 | Z = 56 |
| Magnesium | Strontium | Barium |
Övergångsmetaller: avsluta elektronisk distribution vid undernivå d.
| Z = 30 | Z = 47 | Z = 75 |
| Zink | Silver | Renium |
Halogener: avsluta elektronisk distribution på undernivå s5.
| Z = 9 |
fråga 2
(Unirio) ”Det konstgjorda hjärtat som placerades i Eloi började utvecklas för fyra år sedan i USA och används redan av cirka 500 personer. Uppsättningen, som kallas Heartmate, består av tre huvudstycken. Det viktigaste är en rund väska på fyra pund, 12 centimeter i diameter och 3 centimeter tjock, gjord av titan - en silvervit metall, lätt och stark. ” Veja Magazine, juli 1999.
Bland metallerna nedan är den som i det sista lagret har ett antal elektroner som är lika med det för titan:
a) C
b) I
c) Ga
d) Mg
e) Xe
Rätt alternativ: d) Mg.
| Titan | elektronisk konfiguration | Lagerfördelning |
| 22Du | 1s2 2s2 2p6 3s2 3p6 4s2 3d2 | 2, 8, 10, 2 |
Från den elektroniska distributionen av titan ser vi att detta element har 2 elektroner i det sista skalet.
| Element | elektronisk konfiguration | Lagerfördelning |
| 6Ç | 1s2 2s2 2p2 | 2, 4 |
| 11På | 1s2 2s2 2p6 3s1 | 2, 8, 1 |
| 31Ga | 1s2 2s2 2p6 3s2 3p6 4s2 3d104p1 | 2, 8, 18, 3 |
| 12mg | 1s2 2s2 2p6 3s2 | 2, 8, 2 |
| 54X och | 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 5s2 5p6 | 2, 8, 18, 18, 8 |
Elementet som också har två elektroner i det sista skalet är magnesium.
fråga 3
(UFPA) Tänk på ett visst kemiskt grundämne vars mest energiska undernivå är 5s2. Dess atomnummer och gruppen i vilken det finns på det periodiska systemet är, respektive:
a) 20; 1A
b) 20; 2A
c) 38; 2A
d) 38; 1A
e) 39; 2A
Rätt alternativ: c) 38; 2A
Genom att göra den elektroniska distributionen fann vi att:
- Det kemiska grundämnet finns i familjen 2A, eftersom det har den mest energiska undernivån s2
- Har atomnummer 38, vilket motsvarar det totala antalet distribuerade elektroner.
- Det ligger i den femte perioden, eftersom den elektroniska distributionen genomfördes upp till det femte lagret.
Genom att kontrollera denna information i det periodiska systemet kan vi bekräfta att det är elementet strontium.
fråga 4
(UFC) En x-atom har en proton mer än en y-atom. Basera på den här informationen och bestäm rätt uttalande.
a) Om y är jordalkaliskt, är x alkalimetall.
b) Om y är en ädelgas är x en halogen.
c) Om y är en övergångsmetall är x en ädelgas.
d) Om y är en ädelgas är x en alkalimetall.
e) x ligger i samma period före atom y i det periodiska systemet.
Rätt alternativ: d) Om y är en ädelgas är x en alkalimetall.
Det periodiska systemet är ordnat i stigande ordning med atomnummer.
Om Y har atomnummer z och X har ett proton mer än det betyder det att dessa två element ligger i samma period och X följer med Y.
Exempel:
| Element | efterföljande element |
| zY | z + 1X |
| 11På | 12mg |
De två grundämnena är under den tredje perioden och magnesium har ett proton mer än natrium.
Enligt detta resonemang måste vi:
a) FEL. En alkalimetall kommer före en jordalkalimetall på det periodiska systemet. Det korrekta påståendet skulle vara: Om y är alkalimetall är x alkalisk jord.
b) FEL. En halogen kommer före ädelgasen på det periodiska systemet. Det korrekta påståendet skulle vara: Om y är halogen är x ädelgas.
c) FEL. Övergångsmetaller och ädelgaser separeras av andra kemiska element och är därför inte sekventiella.
d) KORREKT. Ädelgaser är den sista gruppen i det periodiska systemet och alkalimetaller den första, så de är sekventiella.
Exempel:
| ädelgas | alkalimetall |
| zY | z + 1X |
| 2han | 3läsa |
Litium, en alkalimetall, har en proton mer än helium, vilket är en ädelgas.
e) FEL. X är i samma period som Y men efter det, inte tidigare som alternativet säger.
fråga 5
Från atomnummer för ett kemiskt element är det möjligt att veta:
a) antalet neutroner i kärnan
b) antalet elektroner i elektrosfären
c) kärnmassan
Svar: b) antalet elektroner i elektrosfären
En atom i marktillståndet är elektriskt neutral. Så att känna till atomnumret, vilket motsvarar antalet protoner (positivt laddade partiklar), vet vi antalet elektroner (negativt laddade partiklar) i elektrosfären.
Till exempel har järn ett atomnummer 26, så i marktillståndet har det 26 elektroner runt kärnan.
Lära sig mer om kemiska element det är atomnummer.
Periodiska och aperiodiska egenskaper
fråga 1
(UFSM) Bedöm om påståendena relaterade till elementens periodiska egenskaper är sanna (T) eller falska (F).
() Beror på elementens atommassor.
() De upprepas med mer eller mindre regelbundna intervall i förhållande till ökningen av atomnummer.
() Är lika i samma grupp av element.
() Liknar samma period av element.
() I samma grupp ökar de numeriska värdena för de periodiska egenskaperna alltid när det finns en ökning av atomantalet.
Den korrekta sekvensen är:
a) V - F - V - F - F
b) V - F - F - V - V
c) F - V - V - F - F
d) F - V - F - V - V
e) V - F - F - V - F
Rätt alternativ: c) F - V - V - F - F
(FALSK) Beror på elementens atommassor.
Enligt Moseleys lag om periodicitet varierar många fysikaliska och kemiska egenskaper hos kemiska element efter atomnummer.
(SANN) De upprepas med mer eller mindre regelbundna intervall i förhållande till ökningen av atomnummer.
Egenskaper som atomradie, atomvolym, densitet, smältpunkt och kokning är exempel på egenskaper som återkommer regelbundet i det periodiska systemet.
(SANN) Liknar i samma grupp av element.
De periodiska grupperna har ordnats med element som har liknande egenskaper.
(FALSK) Är lika under samma period av element.
Fastigheter liknar familjer, inte perioder. Under perioder fördelas elementen efter antalet elektroniska lager.
(FALSK) I samma grupp ökar de numeriska värdena för de periodiska egenskaperna alltid när det ökar atomantalet.
Egenskaper kan öka eller minska beroende på atomnummer. Ett exempel på detta är elektronegativitet, som minskar när atomantalet ökar i en given grupp.
Läs också: Periodiska egenskaper
fråga 2
(FAESP) Elementens aperiodiska egenskaper är:
a) densitet, atomvolym och atommassa.
b) smältpunkt, elektronegativitet och specifik värme.
c) atomvolym, atommassa och smältpunkt.
d) atommassa, specifik värme och smältpunkt.
e) atommassa och specifik värme.
Rätt alternativ: e) atommassa och specifik värme.
De aperiodiska egenskaperna upprepas med jämna mellanrum.
Atommassa är måttet på atomens vikt i atommasseenheter, vilket motsvarar av kol-12-massan.
Specifik värme bestämmer mängden värme som behövs för att öka temperaturen med 1 ° C på 1 g av elementet.
Dessa två egenskaper är inte relaterade till elementets position på det periodiska systemet.
De andra egenskaperna klassificeras som periodiska eftersom de ökar eller minskar med atomnummer. Är de:
- Densitet: representerar kvoten mellan massan och volymen hos ett element.
- Atomvolym: representerar volymen för en uppsättning atomer och påverkar avståndet mellan dem.
- Smältpunkt: temperatur vid vilken övergången från fast till vätska sker.
- Elektronegativitet: atomens förmåga att locka till sig det elektroniska paret som det delar i en kovalent bindning.
Läs också: elektronnegativitet och Elektronisk tillhörighet
fråga 3
(PUC-PR) Vilka är korrekta bland följande diagram relaterade till det periodiska systemet?
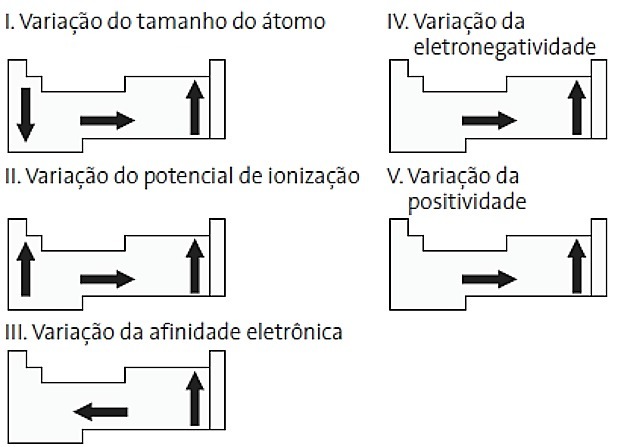
a) II och V
b) II och III
c) I och V
d) II och IV
e) III och IV
Rätt alternativ: d) II och IV.
I. FEL. Atomstorleksvariation mäts av medelavståndet från kärnan till den yttersta elektronen. De största atomerna finns längst ner i tabellen, så ökningen sker enligt atomnumret och den korrekta representationen är:
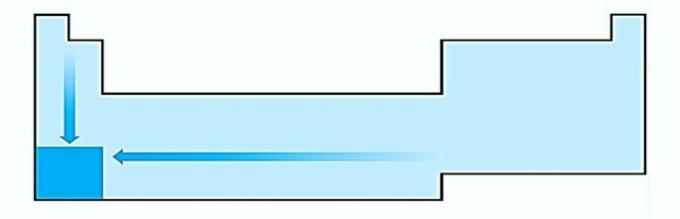
II. KORREKT Den energi som krävs för att riva en elektron av en isolerad atom i gasform kallas joniseringspotentialen. Det ökar som visas i uttalandediagrammet.
III. FEL. Elektronisk affinitet uttrycker den energi som frigörs när en neutral atom i gasformigt tillstånd tar emot en elektron, vilket är en mycket viktig egenskap hos icke-metaller. De högsta elektroniska affiniteterna observeras i halogener och syre.
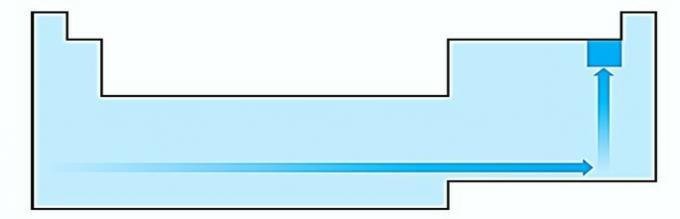
IV. KORREKT Elektronegativitet är relaterad till joniseringspotential och elektronaffinitet. Som sådana är halogener de mest elektronegativa elementen i det periodiska systemet.
V. FEL. Elektropositivitet sker i motsatt riktning till elektronegativitet. Det representerar atomens förmåga att ge upp elektroner.
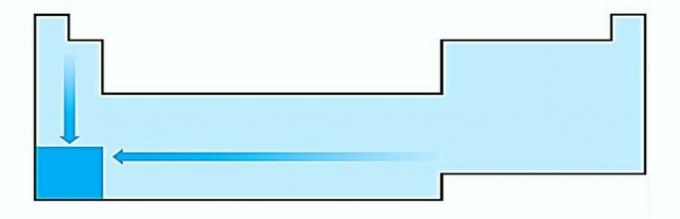
Därför har alkalimetaller den högsta elektropositiviteten.
Fortsätt testa dina kunskaper med listorna:
- Övningar på kemiska bindningar
- Övningar om elektronisk distribution
- Övningar på atommodeller
- Övningar om termokemi