Analysen av de fysikaliska och kemiska egenskaperna hos föreningar som utför kovalenta bindningar (genom att dela elektroner) visar att det finns stora skillnader mellan dessa material. Men innan vi tittar på dessa egenskaper själva, låt oss se vad skillnaden är mellan molekylära och kovalenta ämnen.
På molekylära ämnen de är de som bildas när atomer är länkade genom kovalenta bindningar, vilket ger upphov till molekyler med ett bestämt antal.
Den kovalenta bindningen kan emellertid också härröra från föreningar i en nätverksstruktur med ett mycket stort och obestämt antal atomer, vilka är makromolekyler. Sådana ämnen kallas kovalenta föreningar eller kovalenta fasta nätverk. Några exempel på dessa föreningar är: diamant (C), grafit (C), kiseldioxid (SiO2) och kiselkarbid (SiC).
Låt oss nu titta på dess huvudsakliga egenskaper:
- Fysiskt tillstånd vid rumstemperatur: Under omgivande förhållanden finns molekylära och kovalenta föreningar i de tre fysiska tillstånden (fast, flytande och gas).
Exempel:
O Fast: socker (sackaros), kiseldioxid (sand), diamant, grafit;
O Flytande: vatten, aceton, etanol;
O Gasformig: Vätesulfid, klorgas, bromgas, vätgas.

- Smältpunkt och kokpunkt: I allmänhet är smält- och kokpunkterna för dessa ämnen mindre än för joniska ämnen.
Kovalenta ämnen har högre koktemperaturer än molekylära, alltid över 1000 ° C. Detta beror på att när deras molekyler är mer förenade och bildar kristallina gitter, är det nödvändigt att ge mer energi för att få dem att ändra sitt tillstånd.
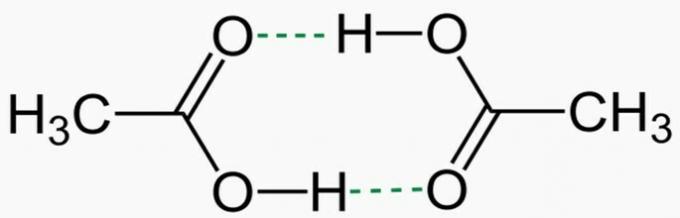
Två faktorer stör kokpunkten och smältpunkterna för kovalenta och molekylära föreningar: a molär massa och den intermolekylär kraft.
Sluta inte nu... Det finns mer efter reklam;)
Ju större molmassa, desto större tröghet hos molekylen och följaktligen desto högre kokpunkt och smältpunkt. Om molmassorna är ungefärliga tittar vi på de intermolekylära krafterna. Den mest intensiva intermolekylära kraften är vätebindningen, vilket leder till högre kokpunkt och smältpunkt. Mellanprodukten är den permanenta dipolen och den svagaste, vilket leder till en lägre kokpunkt och smältpunkt, är den inducerade dipolen.
- Elektrisk ström: I sina rena former leder inte både vätskor och fasta ämnen elektrisk ström.
Ett undantag är grafit, som leder elektrisk ström i fast form, eftersom dess dubbelbindningselektroner resonerar och därför har en viss rörlighet.
- Löslighet: Polar löser sig i polärer och icke-polar upplöses i icke-polära.
- Envishet: Motståndet hos kovalenta ämnen mot slag eller mekanisk chock är lågt. I allmänhet är de spröda fasta ämnen, såsom visas i fallet med glas, som bildas av natrium- och kalciumsilikater.

- Seghet: I allmänhet har de hög hårdhet. Med undantag av grafit, eftersom dess kolatomer är kopplade till tre andra kolatomer, vilket bildar sexkantiga plattor med viss rörlighet, vilket gör den mjuk. På grund av detta används det till och med som smörjmedel.
Hårdheten hos dessa ämnen varierar beroende på typen av kristall, som visas i tabellen nedan:

Av Jennifer Fogaça
Examen i kemi
Vill du hänvisa till texten i en skola eller ett akademiskt arbete? Se:
FOGAÇA, Jennifer Rocha Vargas. "Egenskaper hos kovalenta och molekylära föreningar"; Brasilien skola. Tillgänglig i: https://brasilescola.uol.com.br/quimica/propriedades-dos-compostos-covalentes-moleculares.htm. Åtkomst den 28 juni 2021.
Joniska föreningar, huvudegenskaper hos jonföreningar, bindning mellan joner, definitiv överföring av elektroner, elektrostatisk attraktionskrafter mellan joner, negativa och positiva joner, anjoner, katjoner, jonbindning, molekylstruktur han