O värme och den Värmeenergi, motiverad av skillnaden mellan temperatur, som flyter från kroppen med högre temperatur till kroppen med lägre temperatur. Energiflödet mellan kroppar med olika temperatur äger rum tills det når termisk balans, när temperaturen på kropparna som bytte värme blir lika.

Även om Internationella systemet för enheter (SI) bestämma att enheten för energi är joule (J), den mest använda enheten för värme är kalori (cal). Ett kalori motsvarar den mängd värme som behövs för att 1 g vatten ska genomgå en temperaturvariation från 14,5 ° C till 15,5 ° C.
Korrespondensen mellan kalorier och joule är att 1 kal motsvarar cirka 4,18 J.
kännbart värme
När en kropp tar emot eller ger en viss mängd värme, kan bara generera temperaturvariationerutan att förekomma förändring av molekylernas aggregeringstillstånd, kallas värmen känslig.
Genom följande ekvation kan mängden känslig värme mottas eller förloras av en kropp bestämmas.
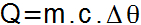
I denna ekvation är motsvarande element och måttenheter:
Q =
Mängden förnuftig värme (kalk);m = Substansmassa (g);
c =specifik värme (kal / g ° C);
Δθ = Temperaturvariation (° C eller K).
Två observationer är viktiga:
O specifik värme det är en karakteristisk mängd av varje typ av ämne som bestämmer mängden värme som krävs för att 1 g av elementet höjer temperaturen med 1 ° C.
Temperaturvariationer kan uttryckas både i ° C hur mycket i K, eftersom dessa två skalor har 100 intervall och presenterar därmed samma variationer.
Exempel
Bestäm mängden känslig värme som behövs för att värma, från 40 ° C till 50 ° C, ett 4 kg prov av ett givet ämne med en specifik värme på 0,5 cal / g ° C.
Frågedata:
Massa m: m = 4 kg = 4000 g
Temperaturområde: Δθ = 50 - 40 = 10 ° C
Specifik värme: c = 0,5 cal / g ° C
Q = mcA2
Q = 4000. 0,5. 10
Q = 20000 cal = 20 kcal
Denna mängd ämne varierar med 10 ° C när den får 20 000 kalk värme.
Av Joab Silas
Examen i fysik
Källa: Brazil School - https://brasilescola.uol.com.br/o-que-e/fisica/o-que-e-calor-sensivel.htm


