
Ibland kan det hända minimiformel vara samma som föreningens molekylformel; detta är dock inte alltid sant.
Till exempel är den empiriska eller minsta formeln för vatten H2O, vilket indikerar att det finns ett förhållande 2: 1 mellan elementen som utgör vattenmolekyler. Och det är också en molekylformel för vatten. För att se att detta inte alltid händer, titta på följande två exempel:
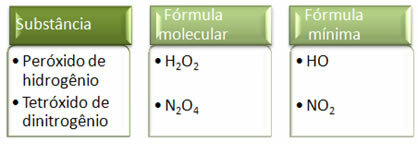
Eftersom minimiformeln endast är förhållandet mellan atomerna för varje element och inte den faktiska mängden av dem i molekylformeln, kan det förekomma av olika föreningar med samma empiriska formel och till och med minsta formel för en förening kan vara densamma som molekylformeln av Övrig. Observera, i exemplet nedan, hur detta kan hända:
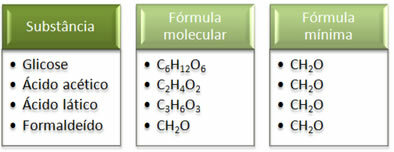
Se att minsta formel CH2Det är detsamma för alla ämnen, det vill säga denna minimala formel uttrycker att i alla fall kol-, väte- och syreatomer är närvarande i molekylformler i ett förhållande av 1:2:1. Dessutom är den enda som har samma molekylformel som den empiriska formeln formaldehyd.
- Minsta eller empiriska formelberäkning:
För att bestämma den empiriska formeln för en förening är det först nödvändigt att veta vilken procentandel eller närmaste formel som är. Detta kan göras genom att mäta massan av varje element i 100 g av ett prov. Texten "Procentuell eller centesimal formel”Klargör denna fråga bättre.
Sluta inte nu... Det finns mer efter reklam;)
Låt oss till exempel säga att den närmaste kompositionen för en given förening ges av: 40,00% C, 6,67% H och 53,33% O. Vi överför dessa värden till gram, med tanke på en massa på 100 g kompostprov. Således har vi: 40 g C, 6,67 g H och 53,33 g O.
Nu är det nödvändigt att skicka dessa värden till mängden materia (mol). Vi gör detta genom att dela vart och ett av värdena som hittas med deras respektive molära massor:
C: 40/12 = 3,33
H: 6,67 / 1 = 6,67
O: 53,33 / 16 = 3,33
Eftersom värdena inte är heltal använder vi följande enhet: vi delar alla värden med de minsta av dem, så att proportionen mellan dem inte ändras.
I det här fallet är det minsta värdet 3,33, så resultatet blir:
C: 3,33 / 3,33 = 1
H: 6,67 / 3,33 = 2
O: 3,33 / 3,33 = 1
Således är minsta formel för detta okända ämne lika med: Ç1H2O1 eller CH2O.
Kortfattat är de steg som behövs för att hitta den empiriska eller minimala formeln för ett ämne:

Av Jennifer Fogaça
Examen i kemi
Vill du hänvisa till texten i en skola eller ett akademiskt arbete? Se:
FOGAÇA, Jennifer Rocha Vargas. "Minsta eller empiriska formel"; Brasilien skola. Tillgänglig i: https://brasilescola.uol.com.br/quimica/formula-minima-ou-empirica.htm. Åtkomst den 28 juni 2021.



