På intermolekylära krafter är ett ämne inom kemi som säkert kan visas i National High School Exam (Och antingen). Därför är det värt att kolla in huvudinnehållet i detta ämne i den här artikeln.
Definition
intermolekylära krafter de är krafter - av varierande intensitet (svag, medium eller stark) - av elektrostatisk attraktion eller bindningar upprättade mellan molekylerna i ett ämne som bibehåller föreningen mellan dem.
Typer av intermolekylära krafter
De) Inducerad dipol
Och den intermolekylär kraft som uppstår mellan molekyler av ett ämne med en icke-polär karakteristik. Det händer till exempel mellan molekyler av ämnen som O2, H2, Nej2, CO2CH4.
Föreningen mellan dessa molekyler inträffar när en dipol skapas mellan dem. Detta händer när elektronerna från en molekyl förskjuter elektronerna från en annan, vilket skapar en negativ och en positiv pol som överförs från en molekyl till en annan.
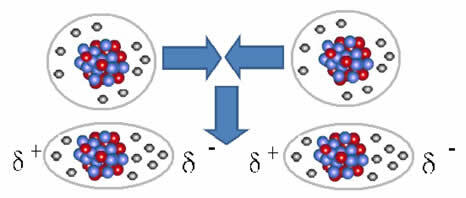
Representation av dipolbildning i icke-polära molekyler
Mellan dessa molekyler bildades två poler, och den negativa polen hos den ena interagerar med den andra polens positiva pol. Eftersom dessa poler skapades är det en intermolekylär kraft med låg intensitet.
B) permanent dipol
Och den intermolekylär kraft som uppstår mellan molekyler av ett ämne med en polär karaktäristik. Exempel är molekyler av ämnen såsom HCN, H2O, NH3, CO, CH3Cl.
Föreningen mellan dessa molekyler sker när den ena negativa polen interagerar med den andra polens positiva pol.
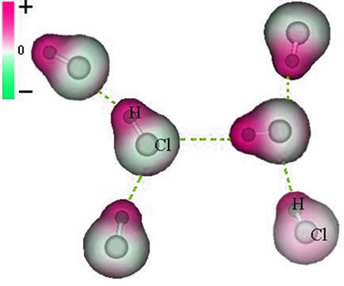
Representation av den permanenta dipolkraften mellan HCl-molekyler
Eftersom polerna redan existerar är den permanenta intermolekylära dipolkraften större än den inducerade dipolen.
ç) vätebindningar
Det där intermolekylär kraft det förekommer mellan polära molekyler som har en väteatom bunden direkt till en syre-, kväve- eller fluoratom.
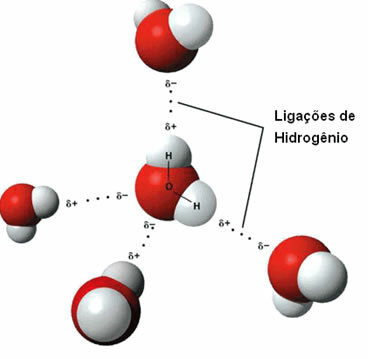
Representation av vätebindningar mellan vattenmolekyler
En vätebindning bildas när väte i en molekyl interagerar med syre, kväve eller fluor i den andra molekylen.
d) dipoljon
Denna intermolekylära kraft uppstår mellan en polär molekyl, som har ett par icke-bindande elektroner, och en jon (katjon eller anjon) i lösningen.
Vattenmolekylen har till exempel två par icke-bindande elektroner i syre. Om det finns joner i det vattenhaltiga mediet kommer de närmare vattenmolekylen, eftersom det finns poler i den.
Sluta inte nu... Det finns mer efter reklam;)
Betydelse
Vikten av att känna till intermolekylära krafter för Enem det är den förståelse de ger när det gäller ämnens fysiska tillstånd, smältpunkt, kokpunkt och löslighet.
De) Förhållande till ämnets smält- och kokpunkt
Smältpunkten indikerar temperaturen för övergången från ett fast till flytande tillstånd och kokpunkten indikerar temperaturen för övergången från en vätska till ett gasformigt tillstånd.
Denna passage är direkt relaterad till interaktionen mellan ämnets molekyler, eftersom det som skiljer ett fysiskt tillstånd från ett annat är aggregeringsnivån mellan dess molekyler.
Ju mer intensiv den intermolekylära kraften är, desto högre smält- och kokpunkter. Ju mindre intensiv den intermolekylära kraften, desto lägre smält- och kokpunkter. Således kan vi definiera den fallande ordningen av smält- och kokpunkten:
Vätebindning> permanent dipol> inducerad dipol
B) Förhållande till löslighet
I allmänhet måste vi veta att liksom upplöses som, det vill säga, polär substans löser polär substans och icke-polär substans löser opolär substans.
Det finns emellertid fortfarande möjligheten till interaktion mellan de lösta molekylerna och lösningsmedelsmolekylerna. Detta händer bara om denna nya interaktion är större än vad som redan finns mellan ämnets molekyler.
Exempel på applicering av intermolekylär kraft i Enem
1: a exemplet: (Enem-2011) Människans hud, när den är väl hydrerad, får god elasticitet och ett mjukt och jämnt utseende. Å andra sidan förlorar den sin elasticitet när den är torr och verkar ogenomskinlig och grov. För att förhindra torr hud är det nödvändigt, när det är möjligt, att använda fuktgivande fuktgivare, vanligtvis gjorda av glycerol och polyetylenglykol:

Vattenretentionen på hudytan som främjas av fuktighetsgivare är en följd av interaktionen mellan hydroxylgrupperna i vätmedlen och fukten i miljön genom:
a) jonbindningar
b) Londons styrkor
c) kovalenta bindningar
d) dipol-dipolkrafter
e) vätebindningar
Svaret på denna fråga är vätebindning, eftersom vattenmolekylen har väte bunden till en syreatom. Detsamma händer med molekylerna propylenglykol och polyetylenglykol, ett gynnsamt tillstånd för förekomsten av denna typ av intermolekylär kraft.
Av mig Diogo Lopes Dias
Vill du hänvisa till texten i en skola eller ett akademiskt arbete? Se:
DAGAR, Diogo Lopes. "Intermolekylära styrkor i fiende"; Brasilien skola. Tillgänglig i: https://brasilescola.uol.com.br/quimica/forca-intermoleculares-no-enem.htm. Åtkomst den 27 juni 2021.


