Kovalent bindning inträffar när två atomer delar elektronpar för att få elektronkonfigurationen av en ädelgas (med 8 elektroner i valensskalet eller med 2, i fallet med de med endast K-skalet), enligt regeln om oktett.
Det finns dock speciella fall av kovalenta bindningar där det delade elektronparet kommer bara från en av de atomer som redan är stabila. Tidigare kallades denna typ av kovalent bindning dativ, idag kallas det oftare samordna.
Se några exempel för att förstå hur detta händer:
- CO (kolmonoxid):
Kol har fyra elektroner i sitt valensskal. För att vara stabil måste den enligt oktettregeln ta emot ytterligare 4 elektroner, totalt 8. Syre, å andra sidan, har 6 elektroner i valensskalet och behöver ta emot 2 elektroner för att få konfigurationen av ädelgasneonet.
Så först delar kol och syre två par elektroner så att syre är stabilt:
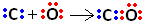
Kol är emellertid instabilt eftersom det fortfarande har 6 elektroner och behöver 2. Därför delar syre, som redan är stabilt, ett av dess elektronpar med kol, det vill säga det gör en dativbindning med det, vilket gör det stabilt:

Observera att den koordinata kovalenta bindningen kan representeras av en streck, precis som den vanliga kovalenta bindningen.
- ENDAST2 (Svaveldioxid):
Varje svavel- och syreatom har 6 elektroner i valensskal, så de behöver ta emot två elektroner vardera. Inledningsvis bildar svavel två vanliga kovalenta bindningar, som delar två par elektroner med en av syreatomerna, båda förblir stabila med 8 elektroner.
Sluta inte nu... Det finns mer efter reklam;)
Men den andra syreatomen är inte stabil, så svavel delar ett par av sina elektroner med den via en koordinerad eller dativ kovalent bindning:
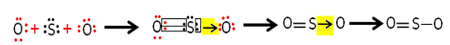
Observera att i detta fall har vi tre atomer i molekylen, så det kan förekomma en migration av bindningen från en atom till en annan. Svaveldioxidmolekylen kan också representeras så här: O ─ S ═ O.
Vi kallar detta bindningsfenomen resonans. Se ytterligare tre exempel i tabellen nedan:
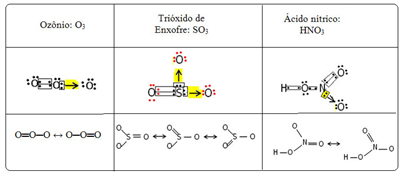
Möjliga strukturer kallas resonansstrukturer eller kanoniska former.
Denna typ av bindning förekommer också vid bildandet av joner, som i fallet med hydroniumjoner (H3O+och ammonium (NH4+).
Först H-katjonen+ den bildas när väte förlorar sin enda elektron och lämnar den med en positiv laddning. Så det måste ta emot två elektroner för att vara stabila. Detta sker genom en dativbindning med vatten (i fallet med hydroniumjonen) och med ammoniak (i fallet med ammoniumjonen). Kolla på:

Av Jennifer Fogaça
Examen i kemi
Vill du hänvisa till texten i en skola eller ett akademiskt arbete? Se:
FOGAÇA, Jennifer Rocha Vargas. "Dativ eller samordnad kovalent bindning"; Brasilien skola. Tillgänglig i: https://brasilescola.uol.com.br/quimica/ligacao-covalente-dativa-ou-coordenada.htm. Åtkomst den 28 juni 2021.


