Som förklaras i texten Lösningar Mättnadbildas kemiska lösningar genom upplösning av a löst på en lösningsmedel. Varje löst ämne har en löslighetskoefficient specifikt, vilket är den maximala mängden löst löst i en given mängd lösningsmedel vid en given temperatur.
Konstruktion av en graf med löslighetskurva
Till exempel löslighetskoefficient av KNO3 är 31,2 g i 100 g vatten vid 20 ° C. Om vi löser exakt den mängden kaliumnitrat i 100 g vatten vid 20 ° C, en mättad lösning. Eventuell ytterligare mängd av detta salt kommer att fällas ut (bildar en bottenkropp i behållaren).

Löslighetskoefficienten varierar emellertid med temperaturen. Så om vi värmer denna mättade lösning med KNO-bottenkropp3kommer fällningen gradvis att lösas upp i vattnet. Se nedan värdena för KNO löslighetskoefficienter3 i 100 g vatten vid olika temperaturer:
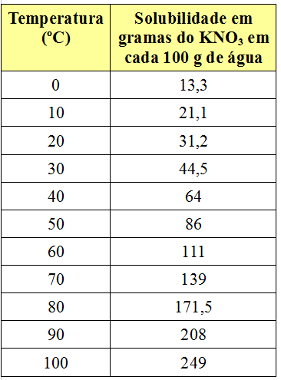
Observera att löslighet av detta salt i vatten ökar med ökande temperatur. I de flesta ämnen är detta också fallet. Om vi lägger dessa värden i a
grafiskkommer vi att ha följande: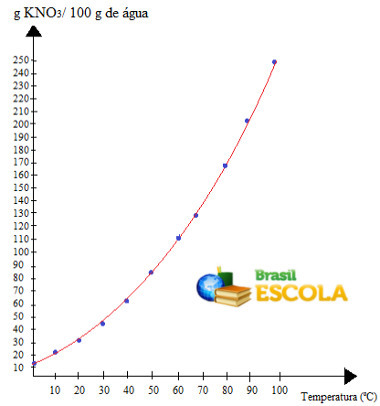
det här är samtalet löslighetskurva av KNO3. Vi säger att den är stigande eftersom den växer med ökande temperatur.
Egenskaper för löslighetskurvor av lösta ämnen i en graf
Varje ämne har sin löslighetskurva för ett givet lösningsmedel. Några av dessa ämnen har minskad löslighet med ökande temperatur, vilket är fallet med CaCrO4, som har löslighetskurva nedåt. Det betyder att om vi värmer en mättad lösning av det saltet kommer en del av det upplösta saltet att fällas ut.
När det gäller andra ämnen stör inte temperaturökningen så mycket i löslighet, som sker med en lösning av bordssalt (NaCl). Vid 20 ° C är löslighetskoefficienten för NaCl 36 g i 100 g vatten, men om vi ökar temperaturen till 100 ° C kommer denna löslighet bara att öka till 39,8 g, en mycket liten ökning.
Sluta inte nu... Det finns mer efter reklam;)
Det finns också ämnen där lösligheten bara ökar upp till en viss punkt av temperaturökningen, för därefter minskar lösligheten. Detta händer till exempel med hydratiserade ämnen, som när de värms upp når en tid då de torkar ut. När dess sammansättning ändras ändras dess löslighetsvariation med temperaturen också. Denna händelse kan observeras i diagrammet genom böjningar i löslighetskurvan.
Nedan presenterar vi en diagram med löslighetskurvor av olika ämnen:
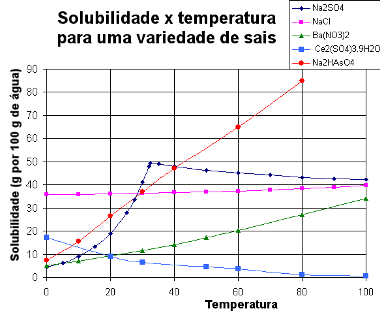
Löslighetskurvor för olika salter
Genom denna typ av diagram kan vi jämföra lösligheterna för olika salter i samma lösningsmedel och vid samma temperaturer.
Klassificering av en lösning med hjälp av ett diagram med en löslighetskurva
På löslighetskurvor de hjälper också till att bestämma mättnaden av lösningar, det vill säga om de är omättade, mättade, bakgrundsmättade eller övermättade. Se ett exempel:
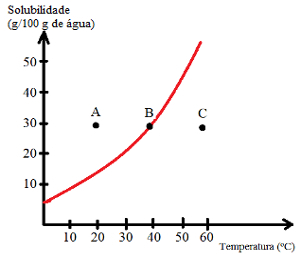
Se vilka typer av lösningar som indikeras av punkterna A, B och C:
A: Mättad med bottenkropp. Vid punkt A löses 30 g löst ämne i 100 g vatten vid 20 ° C. Kurvan visar att löslighetskoefficienten vid denna punkt är cirka 15 g / 100 g vatten. Eftersom mängden närvarande löst ämne är större erhålls således en mättad lösning med en bottenkropp.
B: Mättad. Punkt B ligger exakt på löslighetskurvan, vilket indikerar att lösningen är mättad, eftersom det finns 30 g löst ämne löst i 100 g vatten vid 40 ° C. Detta är alltså exakt löslighetskoefficienten för denna lösta substans vid denna temperatur.
C: Omättad. Det finns 30 g löst ämne löst i 100 g vatten vid 60 ° C. Kurvan visar att löslighetskoefficienten vid denna punkt är större än 50 g / 100 g vatten. Eftersom mängden löst löst ämne är mindre än löslighetskoefficienten, finns det således en omättad lösning.
Således kan vi dra slutsatsen att:
Punkter ovanför kurvan: mättade lösningar med bakgrundskropp;
Poäng på kurvan: mättade lösningar;
Pekar under kurvan: omättade lösningar.
Av Jennifer Fogaça
Examen i kemi
Vill du hänvisa till texten i en skola eller ett akademiskt arbete? Se:
FOGAÇA, Jennifer Rocha Vargas. "Grafer över löslighetskurvor"; Brasilien skola. Tillgänglig i: https://brasilescola.uol.com.br/quimica/graficos-das-curvas-solubilidade.htm. Åtkomst den 28 juni 2021.
Kemi

Dissociation and Ionization, Italian Scientist Volta, Electric Current, Swedish Physical Chemist Svant August Arrhenius, Theory of Arrhenius, positiva joner, katjoner, negativa joner, anjoner, kaustisk soda, bordssalt, polära molekyler, dissociation jonisk,



