I texten "Titel eller massprocent”Vi såg hur man beräknar förhållandet mellan massan av löst ämne och massan av lösningen för fasta, flytande och gasformiga lösningar. I denna text kommer vi dock att se att det också är möjligt att beräkna titern i volymmässigt avseende lösningar med flytande eller gasformiga komponenter.

Titeln i volym kan beräknas med uttrycket:
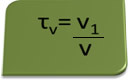
Tänk som ett exempel på en vattenlösning av etylalkohol som används som ett antiseptiskt medel och desinfektionsmedel beredd genom att tillsätta 70 ml ren alkohol till tillräckligt med vatten för att ge upp till en volym av 100 ml lösning. Så vi har:
τ = 70 ml = 0,7
100 ml
Vi kan också uttrycka titeln i procent, bara multiplicera resultatet med 100%. Så i det här fallet har vi en 70% etylalkohollösning, vilket innebär att av 100 volymenheter i lösningen är 70 volymenheter alkohol.
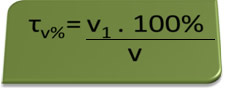
I nedanstående fall har vi en 70% etylalkohollösning i en 250 ml volym lösning; vilket innebär att 175 ml är alkohol, enligt beräkningarna:
100 ml 70 ml alkohol
250 ml x
x = 70. 250
100
X = 175 ml alkohol

Vi kan dock inte säga att vi i det här fallet har 75 ml (250-175) vatten. Till skillnad från masstiter, där vi kan lägga lösningsmedlets massa till lösningsmedlets massa för att hitta lösningen, kan detta inte göras i förhållande till volymtitern.

Sluta inte nu... Det finns mer efter reklam;)
Detta innebär att lösningsvolymen inte är lika med summan av lösningsmedelsvolymen och den lösta volymen (även om skillnaden ofta kan anses försumbar). Detta beror på att de intermolekylära krafterna som finns i dessa vätskor påverkar den slutliga volymen.
När det gäller ovannämnda lösning, till exempel etylalkohol, när vi blandar alkohol med vatten, sker en sammandragning av den totala volymen av lösningen; det vill säga den slutliga volymen kommer att vara mindre än om vi adderade volymen alkohol och vatten enbart. Detta beror på att alkoholmolekylerna skapar bindningar eller vätebindningar med vattenmolekylerna, vilket minskar mellanrummen mellan dem.
I detta och andra fall måste därför lösningsvolymen mätas experimentellt när den inte ges i övningen.
Volymprocenten används ofta i fall av alkoholhaltiga drycker och kommersiell alkohol, som nämnts ovan. Se två viktiga tillämpningar av denna beräkning:
- Andningsapparat: andningsapparaten mäter koncentrationen av etylalkohol i blodet, och i Brasilien är det förbjudet för någon att köra någon typ av fordon med en blodalkoholhalt som är lika med eller över 0,1 volymprocent. En person med detta alkoholinnehåll har, för varje liter blod, 1 ml alkohol, enligt följande beräkningar:
τv%=V1. 100%
v
0,1 % = V1. 100%
1L
V1 = 0,1% → V1 = 0,001 L = 1 ml
100%

- Etanolinnehåll i bensin: i Brasilien regleras bensin genom tillsats av etanol. Men etanolhalten i bensin måste vara högst 24 volym-% vattenfri alkohol (eftersom bensin måste vara vattenfri). Ju mer etanol som tillförs bensin, desto mer blir bränslets färg ljusare och densiteten ökar.
Av Jennifer Fogaça
Examen i kemi
Vill du hänvisa till texten i en skola eller ett akademiskt arbete? Se:
FOGAÇA, Jennifer Rocha Vargas. "Volymtitel på en kemisk lösning"; Brasilien skola. Tillgänglig i: https://brasilescola.uol.com.br/quimica/titulo-volume-uma-solucao-quimica.htm. Åtkomst den 28 juni 2021.
Kemi

Hur Breathalyzer fungerar, alkoholkoncentration, andningsapparat, reaktioner med etylalkohol, typer av andningsapparater, kaliumdikromat, bränslecell, katalysator, elektronfrisättning, ättiksyra, väte, conce



