O beräkna antalet atompartiklar används för att indikera mängden protoner (i kärnan), elektroner (i elektrosfären) och neutroner (i kärnan) som finns i någon atom eller jon. För att göra detta är det viktigt att känna till några egenskaper hos atomer:
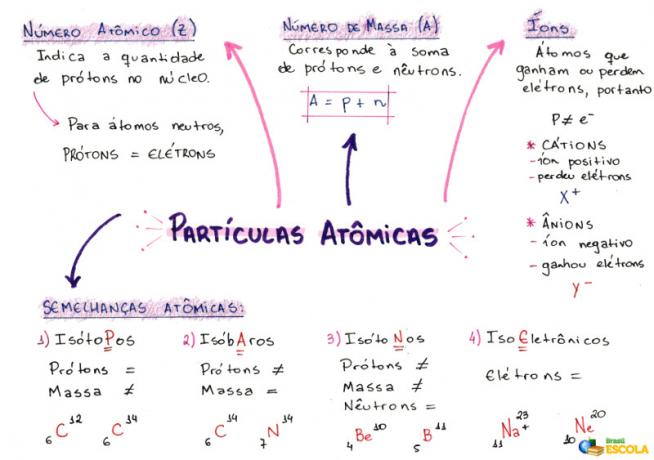
1- Atomnummer (Z)
Det är en matematisk kod, representerad av stora bokstäver Z, placerad på nedre vänstra sidan av en atoms akronym:
ZX
Den anger antalet protoner (p) i kärnan och antalet elektroner (e) i en atoms elektrosfär. Så i allmänna termer:
Z = p = e
2- Massnummer (A)
Det är en matematisk kod som motsvarar summan av antalet protoner (p) och neutroner (n), båda närvarande i kärnan i vilken atom som helst. Ekvationen som representerar massantalet ges av:
A = p + n
Eftersom antalet protoner är lika med atomnumret kan vi skriva ekvationen för att beräkna massantalet enligt följande:
A = Z + n
Om vi vet massornas atomnummer och atomnummer kan vi bestämma antalet neutroner enligt följande:
n = A - Z
3- joner
De är atomer som förlorar eller får elektroner. De har ett positivt eller negativt tecken placerat längst upp till höger om sin representation, som i följande modell:
X+ eller X-
Positiv jon: Detta kallas en katjon och det positiva tecknet indikerar att den har tappat elektroner.
Negativ jon: Detta kallas en anjon och det negativa tecknet indikerar att den har fått elektroner.
Sluta inte nu... Det finns mer efter reklam;)
4- Atomiska likheter
a) Isotoper
Atomer som har samma atomnummer och olika massnummer. Exempel:
7X14 och 7Y16
Atomerna X och Y har samma atomnummer (till vänster om akronymen), det vill säga lika med 7. Atom X har ett massnummer (till höger om akronymen) lika med 14, och atom Y har ett massnummer som är lika med 16.
b) Isobar
Atomer som har samma massnummer och olika atomnummer. Exempel:
15X31 och 13Y31
Atomerna X och Y har ett massnummer (till höger om akronymen) lika med 31. Atom X, å andra sidan, har ett atomnummer som är lika med 15, och atom Y har ett atomnummer som är lika med 13.
c) Isotoner
Atomer som har olika massnummer och atomnummer, men samma antal neutroner.
d) Isoelektronik
Atomer som har samma antal elektroner. Exempel:
12X+2 och 7Y-3
Atom X har ett atomnummer som är lika med 12 och är en katjon (med en positiv laddning +2), så den förlorar två elektroner och har därmed 10 elektroner i sin elektrosfär. Atom Y, å andra sidan, har ett atomnummer lika med 7 och är en anjon (med en negativ laddning -3), så den får tre elektroner och har därmed 10 elektroner i sin elektrosfär.
Mind Map: Atomic Particles
* För att ladda ner mind map i PDF, Klicka här!
Exempel på beräkning av antalet atompartiklar
Exempel 1: Bestäm antalet protoner, neutroner och elektroner i atomen 14X29.
Följande värden för atom X gavs:
Massnummer (uppe till höger) = 29
Atomnummer (nere till vänster) = 14
För att bestämma antalet protoner:
Antalet protoner är alltid lika med atomnumret, så X-atomen har 14 protoner.
För att bestämma antalet elektroner:
Eftersom atomen X inte är en jon är antalet elektroner därför lika med antalet protoner, det vill säga 14.
För att bestämma antalet neutroner:
Antalet neutroner bestäms med hjälp av antalet massa och protoner i följande formel:
A = p + n
29 = 14 + n
29 - 14 = n
n = 15
Exempel 2: Bestäm antalet protoner, neutroner och elektroner av jon X+3med vetskap om att deras massnummer och atomnummer är 51 respektive 23.
Följande värden för jon X gavs:
Massnummer = 51
Atomnummer (nere till vänster) = 23
För att bestämma antalet protoner:
Antalet protoner är alltid lika med atomnumret, så X-atomen har 23 protoner.
För att bestämma antalet elektroner:
Jonen X är positiv (+3), så det är en katjon som har tappat tre elektroner. Så dess antal elektroner är 20.
NOTERA: Minskningen eller ökningen av antalet elektroner sker alltid i förhållande till atomnummer.
För att bestämma antalet neutroner:
Antalet neutroner bestäms med hjälp av antalet massa och protoner i följande formel:
A = p + n
51 = 23 + n
51 - 23 = n
n = 28
Exempel 3: En atom W har ett atomnummer och massa lika med respektive 29 och 57, varvid isobar är a atom Y, som har ett atomnummer lika med 30, vilket är isotop för en atom B, vars massnummer är 65. Bestäm med denna information antalet protoner, neutroner och elektroner i atom B.
Uppgifter från övningen:
Atom W.
atomnummer (nere till vänster) = 29
massnummer (uppe till höger) = 57
Y isobar, dvs massan av Y är också 57.
Y-atom
atomnummer = 30
massnummer = 57
Med dessa två värden måste vi bestämma dess neutronnummer eftersom det är isoton av element B:
A = Z + n
57 = 30 + n
57 - 30 = n
n = 27
Atom B:
massnummer = 65
antal neutroner = 27
Med dessa data måste vi bestämma dess atomnummer, för med det kommer vi att bestämma dess antal protoner och dess antal elektroner (eftersom det inte är en jon):
A = Z + n
65 = Z +27
65 - 27 = Z
Z = 38
Därför har atomen B 38 protoner, 38 elektroner och 27 neutroner.
* Mind Map av Victor Ricardo Ferreira
Kemilärare
Av mig Diogo Lopes Dias