Tänk dig att du tillsätter 10 g bordssalt (natriumklorid - NaCl) i ett glas med 100 g vatten vid 20 ° C. Efter blandning ser du att saltet har löst sig helt, så du bestämmer dig för att tillsätta ännu mer salt. Vid någon tidpunkt kommer du inte längre att kunna lösa upp saltet i den mängden vatten, och eventuellt tillsatt salt sjunker till botten av glaset, oavsett hur hårt du försöker blanda det.
När det händer säger vi att lösningen är mättad och att löslighetskoefficient. Därför kan vi definiera löslighetskoefficienten enligt följande:
“Löslighetskoefficienten är den maximala mängden löst ämne som solubiliseras i en given mängd lösningsmedel vid en given temperatur. ”
Löslighetskoefficienten för salt i vatten är till exempel lika med 36 g NaCl / 100 g vatten vid 20 ° C. Det är inte möjligt att lösa upp ett extra gram salt i denna mängd vatten och vid denna temperatur, som löslighetskoefficienten är specifik för varje ämne. Om vi till exempel byter löst ämne ersätter vi bordssalt med NH4Cl, detta har en löslighetskoefficient lika med 37,2 g i 100 g vatten vid 20 ° C.
Dessutom, samma ämne har olika lösligheter i olika lösningsmedel. Medan salt är lösligt i vatten är det praktiskt taget olösligt i aceton eller etylacetat (ett lösningsmedel som används för att avlägsna glasyr).
En annan punkt är att närhelst löslighetskoefficienten för ett löst ämne i en given mängd lösningsmedel nämns, det är också nödvändigt att ange temperaturen, eftersom detta är en störande faktor. Om vi till exempel tar 100 g vatten vid 20 ° C och tillsätter 40 g salt kommer 36 g att solubilisera och 4 g bildar fällningen. Men om vi tar den här lösningen till uppvärmning kommer vi att se att 4 g löser sig när temperaturen stiger.
Detta visar oss att samma lösta ämne löst i samma mängd lösningsmedel har olika löslighetskoefficienter när temperaturen ökar.
Sluta inte nu... Det finns mer efter reklam;)
Se ett exempel nedan:
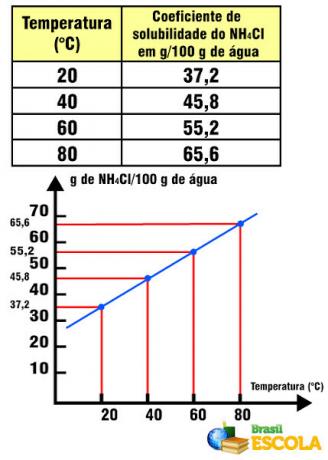
NH-löslighetskoefficient4Cl i förhållande till temperaturen
Observera att i detta fall löslighetskoefficienten för NH4Cl ökar med ökande temperatur. Detta händer med de flesta salter i vatten. Det finns emellertid situationer där löslighetskoefficienten minskar med ökande temperatur, som i fallet med Ce2(ENDAST4)3. Det finns också fall där det inte finns en så markant variation i löslighetskoefficienten, som förekommer med bordssalt. Se detta i texten Grafer över löslighetskurvor.
Det kan vara så att vi också i vissa specifika situationer kan lösa upp en mängd löst i lösningsmedlet som är större än dess löslighetskoefficient och därmed erhålla den så kallade övermättad lösning. Tänk dig till exempel att en lösning bildad med 100 g vatten vid 20 ° C och 40 g bordssalt (med 36 g löstes och 4 g fälldes ut), upphettas tills den når en temperatur vid vilken all löst ämne solubilisera dig själv. Sedan får denna lösning vila så att den svalnar tills den når rumstemperatur, som är nära 20 ° C.
Om det inte finns någon störning i lösningen förblir den extra lösningen upplöst och utgör således en övermättad lösning. Denna typ av lösning är emellertid mycket instabil, och varje plötslig rörelse kan orsaka mängden över löslighetskoefficienten för att temperaturen ska kristallisera. Således, den lösning som var övermättad kommer att bli mättad med bakgrundskropp.
Ett sista fall är omättad lösning, vilket är när mängden löst löst ämne är mindre än värdet på löslighetskoefficienten. Ett exempel är upplösningen av 10 g NaCl i 100 g vatten vid 20 ° C.
Av Jennifer Fogaça
Examen i kemi
Vill du hänvisa till texten i en skola eller ett akademiskt arbete? Se:
FOGAÇA, Jennifer Rocha Vargas. "Löslighetskoefficient"; Brasilien skola. Tillgänglig i: https://brasilescola.uol.com.br/quimica/coeficiente-solubilidade.htm. Åtkomst den 28 juni 2021.