Енергијаунутрашње је збир кинетичке енергије и потенцијал повезан са кретањем саставних атома и молекула тела. Унутрашња енергија је такође директно пропорционална температура тела. То је скаларна величина измерена у џулима (СИ) и одређена у функцији променљивих као што су притиска (П), запремину (В) и температура термодинамика (Т) система, у Келвин (К).
Што је температура тела виша, то је већа његова унутрашња енергија, стога је већа способност да обавља неки посао. Даље, унутрашња енергија моноатомских гасова, на пример, дата је искључиво збиром кинетичке енергије сваког атома гаса. Када се ради о молекуларним гасовима, као што су двоатомни гасови, мора се узети у обзир молекуларне интеракције и, за ово, унутрашња енергија се одређује збиром кинетичке енергије молекула са потенцијалном енергијом која постоји између они.
Не заустављај се сада... После оглашавања има још;)
Унутрашња енергија идеалних моноатомских гасова
Како не постоји интеракција између атома идеалног моноатомског гаса, његова унутрашња енергија зависи искључиво од две променљиве: броја молова (н) и температуре гаса (Т). Гледати:
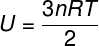
У - унутрашња енергија
не - број мадежа
Р. - универзална константа савршених гасова
Т. - температура
У горњој једначини, Р. има модул од 0,082 атм. Л / мол. К или 8,31 Ј / мол. К (СИ). Такође, горњу једначину можемо написати у терминима других величина, као што су притисак и запремина. За то морамо да се сетимо Цлапеиронова једначина, користи се за идеалне гасове.
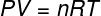
Замењујући горњу једначину за претходну, имаћемо следећи израз за израчунавање унутрашње енергије:
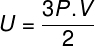
Гледајтакође:Шта је савршен гас?
Узимајући у обзир горње једначине, могуће је утврдити везу између кинетичке енергије атома идеалног моноатомског гаса и његове температуре. За ово ћемо констатовати да је кинетичка енергија ове врсте гаса чистокинетика. Гледати:
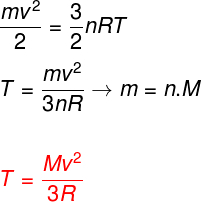
м - тестенина
не - број кртица
М. - моларна маса
У многим ситуацијама је занимљиво знати како израчунати варијацију унутрашње енергије (ΔУ) гаса, јер ова количина показује да ли гас је добио или дао у енергије. Ако је варијација унутрашње енергије гаса била позитивна (ΔУ> 0), гас ће добити енергију; у супротном (ΔУ <0), гас ће се одрећи дела своје енергије.
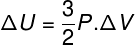
Интерна варијација енергије у смислу промене запремине гаса.
Унутрашња енергија за двоатомне гасове
За идеалне двоатомне гасове унутрашња енергија даје се мало другачијом једначином.
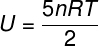
Унутрашња енергија у термодинамичким трансформацијама и циклусима
Према 1. закон термодинамике, унутрашња енергија идеалног гаса може у неким случајевима варирати термодинамичке трансформацијеу зависности од количине размењене топлоте између околине и система, као и од рада који систем врши или на њему.
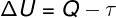
К - топлота
τ - посао
Даље, погледајмо облик који овај закон има за неке одређене термодинамичке трансформације.
Гледајтакође:Историја термичких машина
→ Унутрашња енергија: изотермичка трансформација
У изотермичка трансформација, нема промене температуре и стога унутрашња енергија остаје константна.
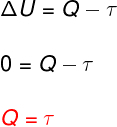
У овом случају, целокупна количина топлоте која се размењује са системом претвара се у рад и обрнуто.
→ Унутрашња енергија: изоволуметријска трансформација
У изоволуметријска трансформација, није могуће изводити посао, јер је систем затворен у крут и нерастегљив контејнер. У овом случају, целокупна количина топлоте која се размењује са системом директно мења његову унутрашњу енергију.
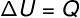
→ Унутрашња енергија: изобарска трансформација
У овој врсти трансформације систем је подвргнут а стални притисак, стога се рад њега или на њему може аналитички израчунати.
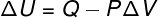
→ Унутрашња енергија: адијабатска трансформација
У адијабатске трансформације, не постоји размена топлоте између система и околине, стога, промена унутрашње енергије зависи искључиво од рада који обавља систем или од њега.
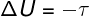
Унутрашња енергија у цикличним процесима
У сваком цикличном процесу термодинамичко стање система, представљено променљивима притиска, запремине и температуре (П, В, Т), је трансформисана, али се на крају враћа у првобитно стање (П, В, Т), стога је промена унутрашње енергије у овој врсти процеса увек нула (ΔУ = 0).
Гледајтакође:Цикличне трансформације
Погледајте доњи графикон који приказује три различите термодинамичке трансформације између стања А и Б.
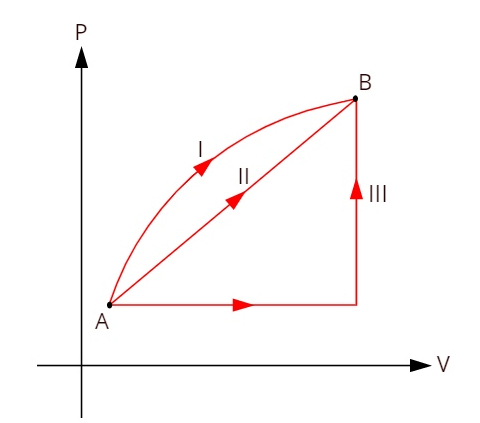
Како три трансформације (И, ИИ и ИИИ) напуштају стање А и прелазе у стање Б, унутрашња варијација енергије мора бити једнака за све њих, према томе:
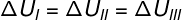
Интерне енергетске вежбе
1) Два мола идеалног двоатомног гаса, са моларном масом једнаком 24 г / мол, налазе се на температури од 500 К у затвореном, крутом контејнеру запремине једнаке 10-3 м³. Одредите:
а) Модул унутрашње енергије овог гаса у џулима.
б) Притисак који гас врши на зидове посуде.
Резолуција:
Тхе) С обзиром да је то идеалан и двоатомни гас, за израчунавање његове унутрашње енергије користићемо формулу испод:
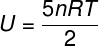
Узимајући податке који су наведени у извештају о вежби, мораћемо да решимо следећи прорачун:
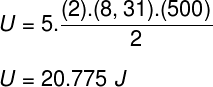
Б) Притисак који гас врши може се утврдити када сазнамо запремину његове посуде: 10-3 м³. Да бисмо то урадили, користићемо следећу формулу:
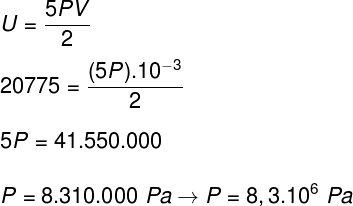
Ја, Рафаел Хелерброцк