ТХЕосмоза и пролаз растварача, из мање концентрованог раствора у концентриранији раствор, кроз полупропустљиву мембрану, све док притисак који раствор врши на мембрану не спречава пролазак растварача. Овај процес је намењен да уравнотежити концентрацију раствора.
Прочитајте и ви: Растворени раствор и растварач
осмотски притисак
ТХЕ осмотски притисак и притисак који се врши на раствор са већом концентрацијом тако да не дође до осмозе, односно да растварач не пређе полупропусну мембрану.
Осмотски притисак се користи у процесима десалинизација воде, форсирајући процес обрнути осмоза, узрокујући прелазак растварача из концентриранијег раствора у мање концентровани раствор. Ми зовемо овај процес обрнути осмоза. Погледајте следећу слику која упоређује два процеса:
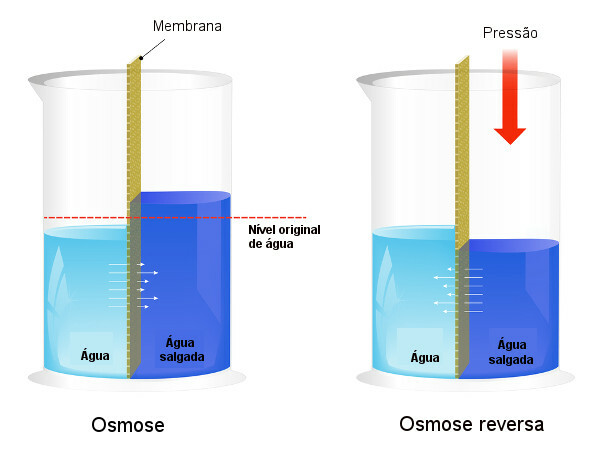
Имајте на уму да је у осмози пролазак растварача у смеру најконцентрисанијег раствора и да је у обрнутој осмози пролазак у супротном смеру, због примењеног притиска. Да бисте сазнали више о теми, прочитајте наш текст: осмотски притисак.
знате више: Обрнута осмоза у десалинизацији морске воде
Не заустављај се сада... После оглашавања има још;)
једначина осмотског притиска
Осмотски притисак, представљен словом пи (π) решења, може се израчунати следећом једначином:
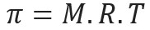
М = концентрација у мол / л
Р = универзална константа савршених гасова
Т = апсолутна температура, у К.
као и други колигативна својства, осмотски притисак зависи од концентрација раствора, односно што је већа концентрација раствора, већи је ефекат осмозе на растворе и, самим тим, већи је осмотски притисак.
Примери
Осмоза се појављује у нашем свакодневном животу у различито време. Можемо навести пример поступак сољења меса вашем конзервација. ти микроорганизми то би проузроковало деградацију меса изгубити водуизнутра ка споља, који има концентрацију соли, што чини да храна дуже траје.
Због соли, такође се дешава да листови салате увену за губљење воде из њихове унутрашњости ћелије (некако мање концентрисано) за каљено решење у спољном окружењу.
Осмоза је такође важна када говоримо о томе крв човече. Кажемо да је Ред Целлс а крв је једна изотонични медијум, односно имају исти осмотски притисак, омогућавајући улазак и излазак воде из ћелије са лакоћом.
Међутим, када крв постане мање концентрисана него у црвеним крвним зрнцима (хипотонични медијум), пролазак воде ће се лакше догодити унутар ћелије, чинећи је набубри до пуцања. Ако крв достигне концентрацију већу од концентрације црвених ћелија (хипертонични медијум), крвна зрнца увену, јер губе воду.

По истом принципу очувања меса, очување воћау компотама од слаткиша, који храну чувају због висока концентрација шећера у решењу.
Следе други примери примене осмозе:
- у порасту сока у проводним посудама биљке;
- у хемодијализа;
- у селективном пролазу хранљивих састојака у ћелијама људског тела.
Да бисте разумели како се осмоза дешава у животињској ћелији, биљној ћелији и другим биолошким проблемима, прочитајте: Осмоза: шта је то и како се јавља у животињској и биљној ћелији.
Написао Вицтор Ферреира
Наставник хемије
Да ли бисте желели да се на овај текст упутите у школи или у академском раду? Погледајте:
ФЕРРЕИРА, Виктор Рикардо. "Осмоза"; Бразил Сцхоол. Може се наћи у: https://brasilescola.uol.com.br/quimica/osmose.htm. Приступљено 28. јуна 2021.