догоди се трансформацијаизохоран када дата маса гаса претрпи промене у температура које покрећу промене притиска или обрнуто, с обзиром да температура и притиска, у овом случају су директно пропорционалне количине, док волумен система остаје непромењен.
Погледајте такође: Шта је парцијални притисак гасова?
Шта је изохорна трансформација?
Изохорна трансформација је када се промена температуре и притиска догоди код дате масе гаса, али његова запремина остаје иста. Промена притиска биће директно пропорционална температури, односно ако гас у одређеном затвореном систему удвостручи апсолутну температуру, то ће довести до повећања притиска на двоструко више него што је био у почетку.
Ова врста трансформације се такође назива изоволуметријска или изометријска. Изохорски термин потиче од грчког Исокхора, на шта исо значи „једнак“ и кхора значи „место или запремина“ (у овом контексту).
Примери:
Гуме аутомобила подвргавају се изохорној трансформацији, то можемо приметити када направимо његову калибрација.
У врућим данима притисак на монитору за калибрацију већи је него у хладним данима. То је зато што се са порастом температуре притисак повећава, пошто запремина остаје.
Други примери су дезодоранси у спреју, код ове врсте производа на етикети постоји упозорење да се не складиште или излажу високим температурама, јер поред тога што су неке од његових супстанци запаљиве постоји и стање изохорне трансформације одн изоволуметријски. Како су аеросолни дезодоранси у затвореној бочици и у гасовитом стању, пораст температуре ће довести до повећања притиска и ризика од експлозије.
Карактеристике изохорне трансформације
- Стална запремина.
- Притисак и температура су директно пропорционални.
Ове карактеристике се могу описати следећим формулама:

График изохорне функције
Обратите пажњу на следећу табелу која описује понашање плина у односу на притисак, температуру и резултујућу константу.
Температура (° Ц) |
Притисак (атм) |
П / Т = константа |
50 |
5 |
10 |
100 |
10 |
10 |
150 |
15 |
10 |
200 |
20 |
10 |
Имајте на уму да притисак прати пораст температуре тако да однос П / Т остаје константан, што значи да су притисак и температура директно пропорционалне величине. Стога је граф који описује изохорне трансформације линеарног типа. Погледајте:

Ко је открио изохорну трансформацију?
Јацкуес Алекандре Цесар Цхарлес (1746-1823) био је француски научник који је, проучавајући понашање гасова у затвореном систему за стварање прецизног термометра, закључио студије о изохорним трансформацијама.
Научник Јосепх Лоуис Гаи-Луссац (1778-1850) такође је развио студију о проширењу и скупљању гасовитог система. То су биле независне анализе, али зато што су дошли до истог закључка, поделили су кредите. Данас се неки аутори позивају на последња два физичка закона гасова који објашњавају изобарске трансформације и изохоран попут 1. и 2. закон Цхарлес-Гаи-Луссац-а.
Погледајте такође: Гаи-Луссац-ов волуметријски закон
Вежберазрешен
Питање 1 - (ПУЦ-РЈ) Бициклистичка гума је калибрирана под притиском од 4 атм, хладног дана, на температури од 7 ° Ц. Количина и количина убризганог гаса су исти. Колики ће бити притисак калибрације у гуми када температура достигне 37 ° Ц?
а) 21,1 атм
б) 4,4 атм
в) 0,9 атм
г) 760 ммХг
е) 2,2 атм
Резолуција
Алтернатива А.
1. корак: идентификујте систем и извуците податке.
Изоволуметријски систем
П1 = 4 атм
Т1 = 7 ° Ц
Т2 = 37 ° Ц
П2 =?
Користећи формулу:
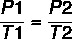
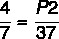
7 к П2 = 37 к 4
П2 = 148/7
П2 = 21,14 атм
Питање 2 - (Унифор-ЦЕ) Испитајте доњу слику.
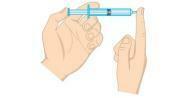
Притисак гаса у шприцу може се смањити:
а) стављање шприца у ледену воду, држећи крај затвореним.
б) стискање клипа, држећи крај затвореним.
ц) стављање шприца у врућу воду, држећи крај затвореним.
г) отварање врха и избацивање половине ваздуха из шприца.
е) повлачењем клипа, држећи крај отвореним.
Резолуција
Алтернатива А. Притисак гаса је директно пропорционалан температури у изохорном систему, односно без промене запремине или масе гаса. Када дође до смањења температуре, доћи ће и до пада притиска.
Аутор Лаиса Бернардес Маркуес де Араујо
Наставник хемије
Извор: Бразил Сцхоол - https://brasilescola.uol.com.br/quimica/transformacao-isocorica.htm

