Ћелије или електрохемијске ћелије и батерије су уређаји у којима се хемијска енергија спонтано претвара у електричну.Ћелија се састоји од само две електроде и електролита, док је батерија скуп батерија у серији или паралелно.
У примарне батерије су уређаји који се не могу пунити, будући да када престане реакција редукције оксидације која се одвија унутар њих, они морају бити одбачени.
За сваку опрему назначена је врста батерије, а међу примарним батеријама које се тренутно користе главне су: Суве ћелије у Лецланцхеу (уобичајене батерије или киселинске ћелије), алкалне батерије и литијум / манган диоксидне батерије.
Погледајте шта их издваја и за коју опрему су погодни:
- Лецланцхе суве ћелије:
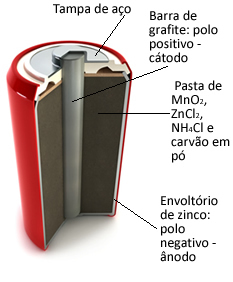
Ове гомиле су у основи формиране цинк-омотачем, одвојеним порозним папиром и централном графитном шипком окруженом манган-диоксидом (МнО2), угљен у праху (Ц) и влажна паста која садржи амонијум хлорид (НХ4Цл), цинков хлорид (ЗнЦл2) и воде (Х.2О).
О. цинк ради попут анода, губљење електрона; то је графит ради попут катода, који проводи електроне до манган-диоксида:
Половина реакције аноде: Зн (с) → Зн2+(овде) + 2 и-
Полуреакција катоде: 2 МнО2 (ак) + 2 НХ41+(овде) + 2е- → 1 Мн2О.3(с) + 2НХ3 (г) + 1 сат2О.(1)
Глобална реакција: Зн (с) + 2 МнО2 (ак) + 2 НХ41+(овде) → Зн2+(овде) + 1 Мн2О.3 (с) + 2НХ3 (г)
Ова врста батерија погодна је за опрему која захтева лагано и непрекидно пражњење, попут даљинског управљача, зидног сата, преносног радија и играчака.
Више детаља о пореклу, функционисању, трајности, ддп, опасностима и мерама предострожности које се морају предузети са овим батеријама можете наћи у тексту „Лецланцхе Дри Стацк”.
Не заустављај се сада... После оглашавања има још;)
- Алкалне батерије:
Његов рад је врло сличан раду лекленских сувих ћелија, међутим, једина разлика је она уместо хлорида амонијума (који је кисела со) додаје се јака база, углавном натријум хидроксид (НаОХ) или калијум хидроксид (КОХ).
Половина реакције аноде: Зн + 2 ОХ → ЗнО + Х2О + 2е-
Полуреакција катоде: 2 МнО2 + Х2О + 2е-→ Мн2О.3 + 2 ОХ
Укупна реакција: Зн +2 МнО2→ ЗнО + Мн 2О.3

Алкалне батерије су корисније од киселих у смислу да имају већу трајност, у обично пружају 50-100% више енергије од обичне батерије исте величине, плус постоји мања опасност од тога цурења.
Углавном су назначени за уређаје који захтевају брже и интензивније преношење, као што су радио, преносни ЦД / ДВД и МП3 плејери, батеријске лампе, дигитални фотоапарати итд.
Прочитајте и текст Алкалне батерије.
- Литијум / манган диоксид батерије:
Ове батерије су лагане и генеришу велики напон (око 3,4 В), због чега се често користе у малој опреми као што су сатови и калкулатори. За разлику од претходних случајева, његов формат је валута, као што је приказано на следећој слици:

Анода је литијум, катода манган-диоксид, а електролит физиолошки раствор:
Половина реакције аноде: читати →читати+ + и−
Полуреакција катоде: МнО2 + прочитајте+ + и−→МнО2(ли)
Укупна реакција: Ли + МнО2 → МнО2(ли)
Јеннифер Фогаца
Дипломирао хемију
Да ли бисте желели да се на овај текст упутите у школи или у академском раду? Погледајте:
ФОГАЊА, Јеннифер Роцха Варгас. „Најчешћи типови ћелија и примарних батерија“; Бразил Сцхоол. Може се наћи у: https://brasilescola.uol.com.br/quimica/tipos-pilhas-baterias-primarias-mais-comuns.htm. Приступљено 27. јуна 2021.
