До изобарне трансформације долази када је гас под сталним притиском. На пример, ако се изврши у отвореном окружењу, трансформација ће бити изобарна јер ће притисак бити атмосферски притисак који се неће мењати.
У овом случају, температура и запремина варирају. Два водећа научника проучавала су како се јавља ова варијација у изобарним трансформацијама. Први који је повезао запремину и температуру гасова био је Јацкуес Цхарлес (1746-1823), 1787. године, а онда је 1802. године Јосепх Гаи-Луссац (1778-1850) квантификовао ову везу.
Тако се појавио закон који објашњава изобарне трансформације гасова, који су постали познати као Цхарлес / Гаи-Луссац закон. Наводи се на следећи начин:
„У систему са константним притиском, запремина фиксне масе гаса је директно пропорционална температури.“

То значи да ако удвостручимо температуру, удвостручиће се и запремина коју заузима гас. С друге стране, ако смањимо температуру, запремина гаса такође ће се смањити у истом проценту.
То се може видети у врло једноставном експерименту. Ако балон ставимо у грло боце, заглавиће се фиксна маса ваздуха. Ако ову боцу умочимо у посуду са леденом водом, балон ће се испухати. Ако га ставимо у посуду са топлом водом, балон ће се напунити.
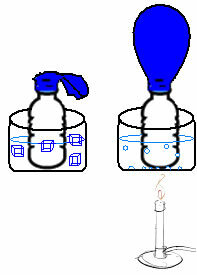
То је зато што се повећањем температуре повећава кинетичка енергија молекула гаса и повећава се брзина којом се крећу. Дакле, гас се шири, повећавајући запремину коју заузима, а балон се надувава. Супротно се дешава када спустимо температуру, стављајући је у хладну воду.
Не заустављај се сада... После оглашавања има још;)
Овај однос температуре и запремине у изобарним трансформацијама дат је следећим односом:
В. = к
Т.
„к“ је константа, као што се може видети на следећем графикону:
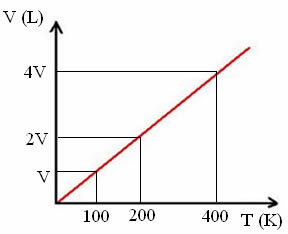
Имајте на уму да однос В / Т увек даје константу:
_В_ =_2В_ = _4В_
100 200 400
Дакле, можемо успоставити следећи однос за изобарске трансформације:
В.почетни = В.Коначни
Т.почетни Т.Коначни
То значи да када дође до било какве промене температуре гаса при константном притиску, његову запремину можемо сазнати кроз овај математички израз. Тачно је и супротно, знајући запремину гаса, сазнајемо на којој је температури. Погледајте пример:
„Плиновита маса заузима запремину од 800 цм3 на -23 ° Ц, при датом притиску. Која је температура забележена када гасовита маса, под истим притиском, заузима запремину од 1,6 Л? “
Резолуција:
Подаци:
В.почетни = 800 цм3
Т.почетни = -23 ºЦ, додајући 273 имамо 250 К (Келвина)
В.Коначни = 1,6 Л
Т.Коначни = ?
* Прво морамо да оставимо јачину звука на истој јединици. Познато је да 1 дм3 једнако 1 литру. попут 1 дм3 је исто што и 1000 цм3, чини се да је 1 литар = 1 000 цм3:
1 Л 1000 цм3
к 800 цм3
к = 0,8 Л
* Сада замењујемо вредности формуле и проналазимо коначну вредност температуре:
В.почетни = В.Коначни
Т.почетни Т.Коначни
0,8_ = 1,6
250 Т.Коначни
0,8 ТКоначни = 250. 1,6
Т.Коначни = 400
0,8
Т.Коначни = 500К
* Прелазећи на Целзијусову скалу, имамо:
Т (К) = Т (° Ц) + 273
500 = Т (° Ц) + 273
Т (° Ц) = 500 - 273
Т (° Ц) = 227 ° Ц
Јеннифер Фогаца
Дипломирао хемију
Да ли бисте желели да се на овај текст упутите у школи или у академском раду? Погледајте:
ФОГАЊА, Јеннифер Роцха Варгас. „Изобарска трансформација“; Бразил Сцхоол. Може се наћи у: https://brasilescola.uol.com.br/quimica/transformacao-isobarica.htm. Приступљено 27. јуна 2021.
Шта су гасови, која су својства гасова, молекуларна једињења, компресибилност, фиксна запремина, кинетичка енергија средња вредност, апсолутна температура гаса, идеални гас, стварни гасови, савршени гас, променљиве стања гаса, запремина гаса, годишња доба
Хемија

Гаи-Луссац-ови закони, Прустов закон, хемијске реакције, константни удео, масе супстанци, чиста супстанца, анализа квалитативни и квантитативни, закон савршених гасова, закон сталних пропорција, закон одређених пропорција, закон волуметријски.