Један од највећих изазова за свако ко учи хемију назива се електронска дистрибуција. Оно што ћемо представити у овом контексту може у великој мери олакшати ваше студије у вези са електронском конфигурацијом коју је предложио научник Линус Паулинг.
Кроз табелу је дат максималан број електрона који стане у сваки слој или ниво енергије:
Слој нивоа енергије Максималан број електрона
1. К 2
2. Л 8
3. М 18
4. Н 32
5 ° О 32
6. П 18
7. К 8
Растући ред енергије поднивоа је редослед у низу дијагонала. Дијаграм Линуса Паулинга приказан је испод:
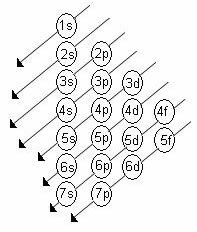
Основна правила:
1. Атомски број (З) елемента, у неутралном стању, указује на број електрона који ће бити распоређени. Овај број је представљен у доњем левом делу симбола елемента.
2. Користећи Паулинг-ов дијаграм, почните да дистрибуирате електроне од врха до дна, узимајући у обзир растући редослед енергије (оријентисан у смеру стрелица).
3. Напуните поднивое максималним нивоом електрона. Ако дати подниво садржи само 6 електрона, немојте премашити ту количину.
4. Проверите број електрона додавањем у сваки подниво.
Применимо то у пракси?
Распоредите електроне атома гвожђа (З = 26).
Ако је атомски број 26, то значи да у нормалном атому гвожђа има 26 електрона. Примењујући Паулингов дијаграм, имаћемо:

Написала Лириа Алвес
Дипломирао хемију
Извор: Бразил Сцхоол - https://brasilescola.uol.com.br/quimica/regras-distribuicao-eletronica.htm
