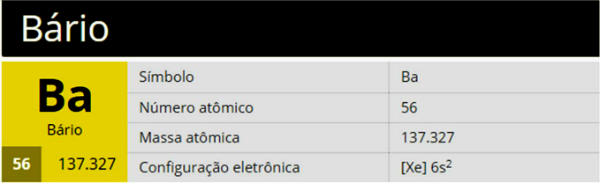
Баријум је хемијски елемент са симболом Ба, атомским бројем 56 и атомском масом 137,327, који припада групи 2 (Породица 2А) периодног система и представља земноалкални метал.
Име му потиче од грчког барис а значи тешка.
Карактеристике
На собној температури налази се у чврстом стању, меке конзистенције и сребрнасте боје. Међутим, у природи се не налази у свом чистом облику, јер се лако оксидира у контакту са ваздухом.
Бариј се налази у руди барита (БаСО4) и витерите (БаЦО3). Главна рударска подручја за ове руде јављају се у Великој Британији, Италији, Чешкој, САД-у и Немачкој.
Баријум има високе тачке топљења (1000 К - 727 ° Ц) и кључање (2170 К - 1897 ° Ц). Још увек је добар проводник електричне енергије.
Веома је реактиван у контакту са водом и алкохолом. Његова реакција са водом производи хидроксид и ослобађа се водоник.
Растворљива једињења баријума су токсична за тело. Упркос томе што се налази у води и храни, количина присутног барија није довољна да изазове здравствене проблеме.
Због велике оксидационе моћи баријум се мора сачувати у минералном уљу.
Сазнајте више, прочитајте такође:
- Хемијски елементи
- Периодни систем
апликације
Међу главним применама баријума су:
- У свом чистом облику користи се за уклањање кисеоника са електронских вентила;
- Отров за пацове, у облику баријум карбоната;
- Користи се као бели пигмент у бојама;
- Производња стакла;
- Баријум сулфат се користи као флуид за бушење нафтних и гасних бушотина;
- Баријев хлорат и нитрат се користе у производњи зеленог пламена у пиротехничким бакљама;
- Баријум-сулфид појачава контраст код рендгенских прегледа дигестивног система и даје се орално пацијентима. Гутање не узрокује здравствене проблеме, јер је супстанца нерастворљива, не акумулира се и брзо се уклања из тела;
Иако је баријев сулфид нешкодљив, баријев карбонат је изузетно токсичан и може бити фаталан. Особа са интоксикацијом има потешкоће са дисањем, повраћањем, дрхтавицом, тахикардијом, повећаним крвним притиском и саливацијом.
Можда ће вас такође занимати:
- Металне везе
- Бакар
- Литијум