У лабораторијама и хемијској индустрији веома је важно знати количину супстанци које су укључене у реакције. Стога ћемо се у наставку бавити главним концептима, величинама и мерним јединицама повезаним са масама атома:
- Јединица атомске масе (у):
Стандардни референтни атом тежине који означава јединицу атомске масе је угљеник-12 (12Ц). Јединица атомске масе (1 у) одговара вредности од 1.66054. 10-24 г, што је маса 1/12 изотопа угљеника са масом једнаком 12 (12Ц).
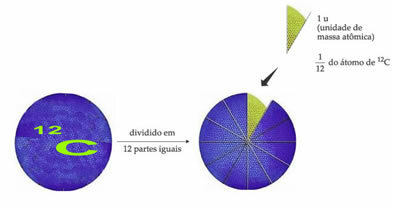
Јединица атомске масе (у) је јединица која се користи у свим количинама наведеним у наставку.
- Атомска маса атома или изотопа (МА):
Добија се упоређивањем са референтном вредношћу споменутом у претходној тачки. На пример, атомска маса 919Ф даје масни спектрометар, који је једнак 18,9984 у. Заокружујући нагоре, једнако је 19, што је иста вредност као и његов масени број (А). Ова вредност значи да је атомска маса елемента 919Ф је 19 пута већа од масе 1/12 од 12Ц.
- Атомска маса елемента (АМ):
Атомска маса елемента одређена је пондерисаним просеком атомских маса његових изотопа. То се постиже множењем атомских маса сваког изотопа са процентом који се појављује у конституцији елемента. Те вредности се затим збрајају, које се деле са 100, што резултира укупним процентом.
На пример, елемент неон се састоји од три изотопа са следећим атомским масама и процентима у својој конституцији:

Израчунавање атомске масе (МА) овог елемента:
ЛОШЕнеон = (20. 90,92) + (21. 0,26) + (22. 8,82)
100
ЛОШЕнеон = 20,179 у
- Молекуларна маса (ММ):
Као што и само име говори, користи се за молекуларне супстанце, односно за атоме повезане дељењем парова електрона, који се називају ковалентне везе.
Молекуларна маса се добија множењем броја атома сваког елемента њиховим атомским масама и збрајањем резултата.
На пример, молекул ЦО2 садржи један угљеник и два кисеоника, па ћемо помножити атомску масу угљеника са 1; и кисеоник за два, додајући их касније:
ММЦО2 = (1. ЛОШЕЦ) + (2. ЛОШЕО.)
ММЦО2 = (1. 12) + (2. 16)
ММЦО2 = 12 + 32
ММЦО2 = 44 у
- Масовна формула:
Исти је прорачун изведен за молекулску масу, међутим, за јонска једињења. У овом случају назив је другачији, јер нису груписани у молекуле, већ у скупове јона. Како молекули не постоје, очигледно нема смисла говорити о молекуларној маси, али образложење које стоји иза израчунавања је исто.
Пример:
НаЦл
↓ ↓
23 +35,5 → Маса формуле = 58,5 у
Јеннифер Фогаца
Дипломирао хемију
Извор: Бразил Сцхоол - https://brasilescola.uol.com.br/quimica/massas-dos-atomos.htm