ТХЕ хидролиза соли између јаких киселина и база јавља се када катион у соли не ступа у интеракцију са анионом у води, а анион у соли не делује са катионом у води. Хидролиза између катјона и ањона соли и воде настаје само када је настали производ слаба киселина, слаба база или обоје. Корак по корак разумите хидролизу соли између јаких киселина и јаких база:
а) Корак 1: јонизација воде
Вода је супстанца која има способност патње аутојонизација, односно производи хидронијум катион (Х+) и хидроксид анион (ОХ-) из његове структуре.
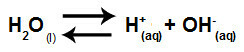
Једначина која представља самојонизацију воде
б) Корак 2: Дисоцијација соли
Када се сол дода води, она пролази кроз процес дисоцијације. Како је сол јонско једињење, у води се његови катјони и аниони ослобађају у подлогу, као у доњој једначини:
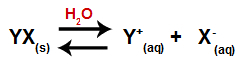
Једначина која представља дисоцијацију било које соли
ц) Корак 3: Хидролиза соли јаких киселина и база
За јаку киселину: када се анион соли комбинује са Х.+ воде да настане ХЦл, ХБр, ХИ или друга киселина у којој је одузимање броја кисеоника бројем водоника једнако или веће од 2, имаћемо
јака киселина. Због тога се комбинација између поменутих јона не јавља.За снажне темеље: када се катион соли која припада породици ИА (алкални метали) или ИИА (земноалкални метали, осим магнезијума) комбинује са ОХ- воде створиће а јака основа. Због тога се комбинација између поменутих јона не јавља.
Када јони соли не ступају у интеракцију са воденим јонима, имамо следећу једначину:
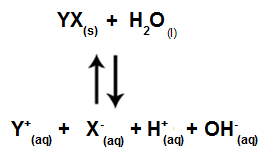
Једначина која показује све јоне присутне у раствору
Укратко, како јони соли не ступају у интеракцију са воденим јонима, јони соли не промовишу било какву промену у коначном раствору. Тако једнаџбу јонизације воде можемо написати једначину хидролизе соли између јаких киселина и јаких база.
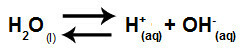
Једначина која представља хидролизу јаких киселина и база
г) Пример хидролизе соли између јаких киселина и база
Када у воду додамо калијум-хлорат-сол (КЦлО3), сол се дисоцира и ослобађа калијум-катион (К+) и ањона хлората (ЦлО3-) у средини.
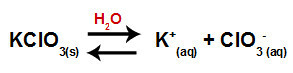
Једначина дисоцијације за калијум хлорат
Важно је запамтити да вода пролази кроз самојонизацију и даје медијуму хидронијум катион (Х+) и хидроксид анион (ОХ-). Сада морамо проценити интеракцију између јона соли и воде.
Када је Х.+ ступа у интеракцију са ЦлО3-, формира хлороводоничну киселину (ХцлО3). Будући да је одузимање броја кисеоника бројем јонизирајућих водоника у хлоровој киселини 2, то је јако. Због тога се интеракција између јона не дешава.
Када је К катион+ ступа у интеракцију са ОХ анионом-, имамо стварање јаке базе, јер је калијум алкални метал. Због тога се интеракција између јона не дешава.
Једначина која представља хидролизу соли између јаких киселина и база од растварања калијум хлората у води је:
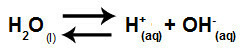
Хемијска једначина хидролизе калијум хлората
Ја сам, Диого Лопес Диас
Извор: Бразил Сцхоол - https://brasilescola.uol.com.br/quimica/hidrolise-salina-entre-acidos-bases-fortes.htm
