Будући да органских једињења има на хиљаде, феномен изомерије може имати неколико облика. Стога се изомерија у основи може класификовати у две врсте: равна или уставна изомерија и свемирска изомерија или стереоизомерија. Свака наведена врста може се поделити, као што је приказано на следећем дијаграму:
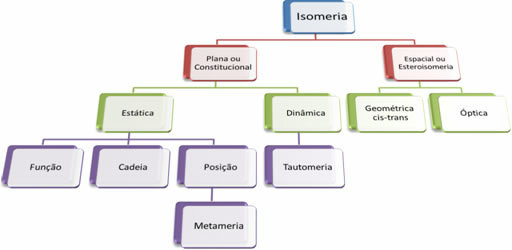
Погледајте сваки случај:
1. Равна или уставна изомерија: Изомери овог типа имају исту молекулску формулу и одликују се равним структурним формулама. Постоји пет случајева равни изомерије: функција, ланац, положај, метамеризам и таутомеризам.
1.1.Функционална или функционална изомерија: Разлика између изомера је у функционалној групи.
Пример: Молекуларна формула Ц.3Х.6О.
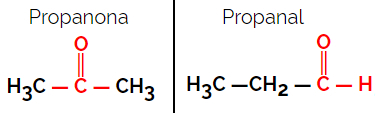
Имајте на уму да је пропанон из кетонске групе, а пропанал из алдехидне групе.
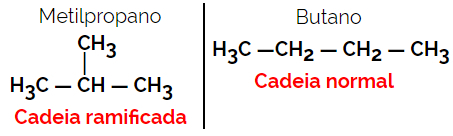
1.2. Ланчани или скелетни изомери: Разлика између изомера је у типу ланца. На пример, један изомер је отвореног ланца, а други затвореног ланца, или један нормалног, а други разгранатог ланца, или је један хомогени ланац, а други хетерогени ланац.
Пример: Молекуларна формула Ц.4Х.10
1.3.Позициона или позициона изомерија: Разлика је у положају незасићења, функционалне групе, хетероатома или супституента.
Пример: Молекуларна формула Ц.4Х.6

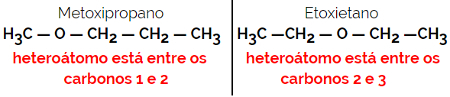
1.4.Компензациона изомерија или метамерија: То је посебна врста изомерије положаја, где је разлика у положају хетероатома.
Пример: Молекуларна формула Ц.4Х.10О.
1.5.Динамична изомерија или таутомерија: То је посебна врста изомерије функције, у којој изомери коегзистирају у динамичкој равнотежи у раствору. Две главне врсте таутомерије су између кетона и енола (кетоенолска равнотежа) и између алдехида и енола (алдоенолска равнотежа).
Пример: Молекуларна формула Ц.3Х.6О.
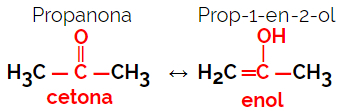
2. Свемирска изомерија или стероизомерија: У овом случају, разлика између изомера може се визуализовати само кроз оријентацију њихових атома у простору. Постоје две врсте стереоизомерије: геометријска изомерија и оптичка изомерија.
2.1.Геометријски или цис-транс изомери: Разлика је у томе што је изомер назван као цис има исте угљеничне лиганде у двострукој вези или у цикличним једињењима на истој страни равни. Лиганди изомера транс налазе се на супротним странама.
Пример: Молекуларна формула Ц.2Х.2Кл2

Ова једињења су тзв стереоизомери.
2.2.Оптички изомер: Појављује се када су изомери способни да одбију сноп поларизоване светлости. Ако савија поларизовани сноп светлости улево, то је леворотациони изомер, али ако се савија удесно назива се дешњак.
Пример:
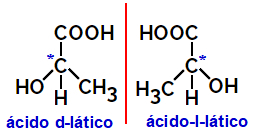
Асиметрични молекули попут оних приказаних горе, који су међусобне слике у огледалу и који се не могу надградити, називају се енантиомери.
Јеннифер Фогаца
Дипломирао хемију
Извор: Бразил Сцхоол - https://brasilescola.uol.com.br/quimica/tipos-isomeria.htm
