имамо мешање раствора са различитим раствореним супстанцама без хемијске реакције када две или више смеша којима су заједничке супстанце са истим јоном (или исти катион или исти анион). Као у доњем примеру:
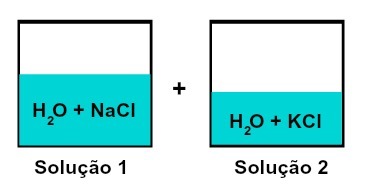
Смеша раствора који имају различите растворене супстанце
Решење 1 је вода и натријум хлорид (НаЦл), док раствор 2 садржи воду и калијум хлорид (КЦл). Када се помешају заједно имамо мешање различитих раствора растворених супстанци без хемијске реакције, јер обе коришћене соли имају хлоридни анион (Цл-).
1- Карактеристике смеша различитих раствора растворених раствора без хемијске реакције
Када се изврши мешање раствора који имају различите растворене материје без хемијске реакције, увек се проверавају доње карактеристике:
Маса сваке од растворених супстанци се не мења (ако у раствору 1 имамо 10 г растворене супстанце, а у 2, 30 г, на пример, после мешања имаћемо исту масу сваке растворене супстанце),
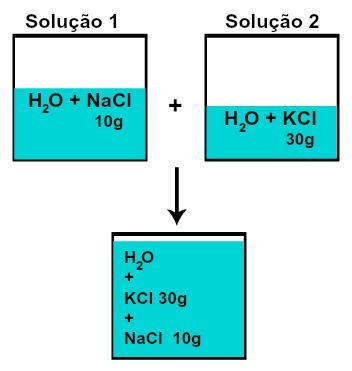
Маса сваког раствореног средства након мешања раствора без хемијске реакције
ТХЕ количина материје
(н) сваке од растворених супстанци се не мења (ако у раствору 1 имамо 5 мол растворене супстанце, а у 2, 4 мола, на пример, после мешања имаћемо исту количину материје сваке од њих),
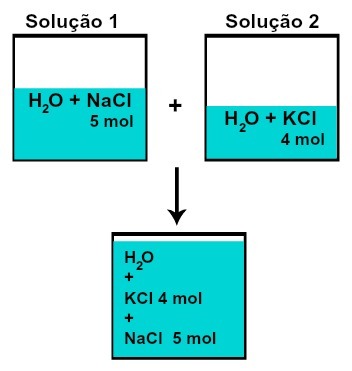
Број молова сваке од растворених супстанци након мешања раствора без хемијске реакције
Обим коначног решења, В.Ф, је резултат збира запремина сваког од мешаних раствора (ако у раствору 1 имамо 200 мл, а у раствору 2, 300 мл, на пример, после мешања имаћемо 500 мл запремине),
В.Ф = В1 + В2
2- Формуле коришћене у прорачунима мешања раствора различитих растворених супстанци без хемијске реакције.
Као што код ове врсте смеше имамо само пораст количине растварача у односу на сваки од растворене супстанце, морамо израчунати коначну концентрацију сваке од растворених супстанци користећи следеће изрази:
а) Да заједничка концентрација (Ц)
За раствор 1: множење концентрације раствора 1 са његовом запремином једнако је коначној концентрацији помноженој са његовом запремином
Ц1.В1 = Ц.Ф.ВФ
За раствор 2: множење концентрације раствора 2 са његовом запремином једнако је коначној концентрацији помноженој са његовом запремином
Ц2.В2 = Ц.Ф.ВФ
б) Да концентрација у количини материје или моларност (М)
За решење 1:
М.1.В1 = М.Ф.ВФ
За решење 2:
М.2.В2 = М.Ф.ВФ
ц) Концентрација у количини материје сваког јона присутног у раствору
Ако морамо да одредимо концентрацију једног или свих јона присутних у коначном раствору, морамо:
1º: Имајте на уму да се концентрација јона даје множењем концентрације (М) растворене супстанце из које потиче, њеним индексом у формули супстанце. Дакле, за јон И, у супстанци 1, КСИ3, концентрација ће бити:
[И]1 = 3. М.
Што се тиче растворених супстанци2, ЗИ, концентрација И би се дала са:
[И]2 = 1. М.
2º: Ако имамо више растворених супстанци које ослобађају исти јон, на пример, растворене супстанце КСИ3 и ЗИ, који имају исти јон И, концентрација овог јона у коначном раствору дата је збиром његових концентрација за сваку растворену супстанцу:
[И]Ф = [И]1 + [И]2
3- Примери прорачуна који укључују мешање раствора различитих растворених супстанци без хемијске реакције
Пример 1: (ПУЦ СП) У чаши је помешано 200 мл воденог раствора калцијум хлорида (ЦаЦл)2) од 0,5 мол концентрације. Л–1 и 300 мл 0,8 мол раствора. Л–1 натријум хлорида (НаЦл). Добијени раствор има концентрацију хлоридног аниона приближно:
а) 0,34 мол. Л–1
б) 0,65 мол. Л–1
в) 0,68 мол. Л–1
г) 0,88 мол. Л–1
д) 1,3 мол. Л–1
Подаци добијени вежбом су:
Решење 1:
Том (В1): 200 мл
Моларна концентрација (М.1): 0,5 мол. Л–1
Решење 2:
Том (В2): 300 мл
Моларна концентрација (М.2): 0,8 мол. Л–1
За одређивање концентрације хлоридних ањона (Цл-), морамо следити ове кораке:
Корак 1: израчунати запремину коначног решења
В.Ф = В1 + В2
В.Ф = 200 + 300
В.Ф = 500 мл
Корак 2: Израчунати моларну концентрацију коначног раствора у односу на раствор ЦаЦл2, користећи израз испод:
М.1.В1 = М.Ф.ВФ
0,5,200 = М.Ф.500
100 = М.Ф.500
100 = М.Ф
500
М.Ф = 0,2 мол. Л–1
Корак 3: Израчунати моларну концентрацију хлорида [Цл-]1, у коначном раствору, из растворене супстанце ЦаЦл2, користећи израз испод:
БЕЛЕШКА: У формули имамо множење моларности са 2, јер имамо индекс 2 у Цл, у формули растворене супстанце ЦаЦл2.
[Кл-]1 = 2.МФ
[Кл-]1 = 2. 0,2
[Кл-]1 = 0,4 мол. Л–1
Корак 4: Израчунати моларну концентрацију коначног раствора у односу на раствор НаЦл, користећи следећи израз:
М.2.В2 = М.Ф.ВФ
0,8,300 = М.Ф.500
240 = М.Ф.500
240 = М.Ф
500
М.Ф = 0,48 мол. Л–1
Корак 5: Израчунати моларну концентрацију хлорида, [Цл-]2, у коначном раствору, из растворене супстанце НаЦл, користећи следећи израз:
БЕЛЕШКА: У формули имамо множење моларности са 1, јер имамо индекс 1 у Цл, у формули за раствор НаЦл.
[Кл-]2 = 1.МФ
[Кл-]2 = 1. 0,48
[Кл-]2 = 0,48 мол. Л–1
Корак 6: Израчунати укупну количину хлоридних јона у коначном раствору
Да бисте то урадили, додајте кораке 3 и 5 моларне концентрације хлорида за сваку од растворених супстанци:
[Кл-]Ф = [Кл-]1+ [Кл-]2
[Кл-]Ф = 0,4 + 0,48
[Кл-]Ф = 0,88 мол. Л–1
Пример 2: У раствор од 500 мл 6 мол / Л КОХ дода се 300 мл раствора К.2САМО3 3 мол / Л. Колика је концентрација сваке од растворених супстанци у насталој смеши
а) 3,75 и 3,0 мол / л
б) 3,75 и 1,221 мол / Л
в) 4,5 и 1,125 мол / Л
г) 3,75 и 1,125 мол / Л
е) 4,5 и 1,215 мол / л
Подаци добијени вежбом су:
Решење 1:
Том (В1): 500 мл
Моларна концентрација (М.1): 6 мол. Л–1
Решење 2:
Том (В2): 300 мл
Моларна концентрација (М.2): 3 мол. Л–1
За одређивање концентрације хлоридних ањона (Цл-), морамо следити ове кораке:
Корак 1: израчунати запремину коначног решења
В.Ф = В1 + В2
В.Ф = 500 + 300
В.Ф = 800 мл
Корак 2: Израчунати моларну концентрацију коначног раствора у односу на раствор КОХ, користећи следећи израз:
М.1.В1 = М.Ф.ВФ
6.500 = М.Ф.800
3000 = М.Ф.800
3000 = М.Ф
800
МФ = 3,75 мол. Л–1
Корак 3: Израчунати моларну концентрацију коначног раствора у односу на раствор К2САМО3, користећи израз испод:
М.2.В2 = М.Ф.ВФ
3.300 = М.Ф.800
900 = М.Ф.800
900 = М.Ф
800
М.Ф = 1,125 мол. Л–1
Ја сам, Диого Лопес Диас
Извор: Бразил Сцхоол - https://brasilescola.uol.com.br/quimica/mistura-solucoes-com-solutos-diferentes-sem-reacao-quimica.htm

