ТХЕ хибридизација угљеника сп-типа то се дешава само када направи две пи везе (π) и две сигма везе (σ). У овом случају постоје две могућности: угљеник може створити две двоструке везе или једноструку и троструку везу, као што је приказано доле:
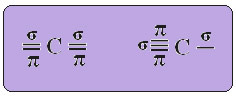
Текст "хибридизација сп типа3”Детаљно показује како се одвија хибридизација угљеника. Подсећање: хибридизација је „мешање“ чистих атомских орбитала, које потичу од хибридних атомских орбитала, једнаких једна другој, али различитих од оригиналних чистих орбитала. Дакле, ово се догађа на угљеничним орбиталама које су првобитно биле представљене овако:
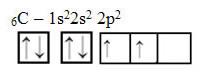
Међутим, примањем енергије, електрон (представљен стрелицом) из 2с орбитале промовише се у 2п орбиталу:
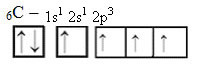
На овај начин, угљеник има четири неспарене орбитале, који могу да направе четири ковалентне везе, а не само две.
У случају хибридизације сп-типа, знамо да ће две везе бити пи; оне се јављају у чистим „п“ орбиталама, док ће друге две орбитале, које су сп хибриди, створити преостале сигма везе.
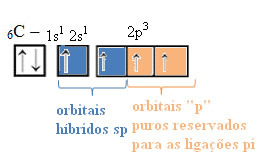
Просторни приказ ове хибридизације између с и п орбитале, која доводи до хибридне сп орбитале, може се представити на следећи начин:
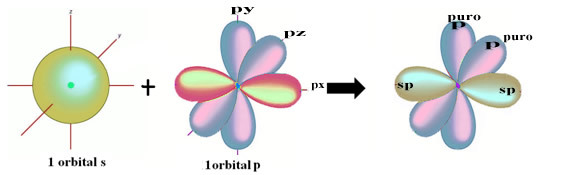
На горњој слици је врло јасно да постоје две чисте орбитале које ће створити пи везе.
Да бисте разумели како се то дешава, узмимо за пример молекул цијанид водоника (ХЦН), који се у Сједињеним Државама користи у гасним коморама за затворенике осуђене на смртну казну. Његова структурна формула дата је:
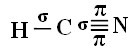
Што се тиче угљеника, његове атомске орбитале су већ приказане, погледајте сада водоничне и азотне орбитале:
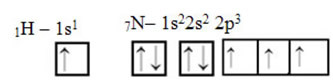
Имајте на уму да је неспарена водонична орбитала, која ће изводити сигма везу, „с“, која је просторно представљена кругом; а азотне орбитале су типа „п“, представљене са три двострука овоида (сваки у просторном пољу: к, и, з). Дакле, структура молекула ХЦН представљена је на следећи начин:
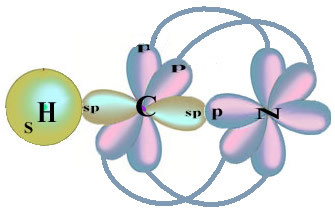
Што се тиче типа веза које постоје у овој формалдехидној структури, имамо:
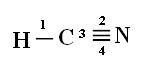
Везе: 1 = σс-сп
2 = σп-сп
3 = 4 = πп-п
Јеннифер Фогаца
Дипломирао хемију
Извор: Бразил Сцхоол - https://brasilescola.uol.com.br/quimica/hibridizacao-tipo-sp.htm
