На температуру кључања органских једињења утичу два фактора: врста интермолекуларне интеракције и величина молекула.
Што је већа величина молекула, то је већа његова температура кључања.
Посматрајте структуре и одговарајуће Т.Е .: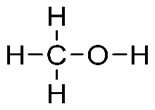 ТИ. (° Ц): 64,5
ТИ. (° Ц): 64,5
Метанол
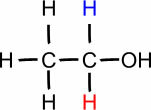 ТИ. (° Ц): 78,3
ТИ. (° Ц): 78,3
Етанол
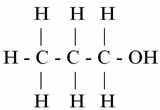 ТИ. (° Ц): 97,2
ТИ. (° Ц): 97,2
Пропанол
Имајте на уму да како молекул повећава број угљеника, тачка кључања постаје већа. Дакле, метанол који има само један атом угљеника кључа на 64,5 ° Ц, а пропанол (3 угљеника) достиже само свој Т.Е. на 97,2 ° Ц.
Али у молекулима једнаке величине? Како знати ко има Т.Е. више?
Одредиће се врста интермолекуларне интеракције.
Пример: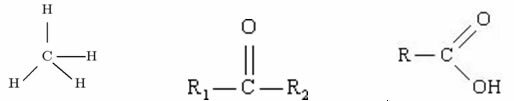
Метан кетон карбоксилна киселина
Међу ове три органске структуре, која од њих има највећи Т.Е.?
У овом случају, не можемо се ослонити на величину молекула као раније, јер се три структуре у том погледу не разликују.
Правило које сада важи гласи: Што је већи интензитет интермолекуларних сила, то је већа температура кључања.
Индуковани дипол
Узлазни редослед интензитета →
На основу ове скале интензитета погледајте које силе превладавају у молекулима:
Метан: индукован диполом
Кетон: дипол-дипол
Карбоксилна киселина: водоничне везе
Овим можемо класификовати који од ових молекула има највишу температуру кључања: киселина карбоксилна киселина има већи Т.Е. јер је водонична веза присутна у овом једињењу највећа интензитет.
Метан
Узлазни редослед интензитета →
Ова шема показује да метан има најнижу тачку кључања због превладавајућег типа интермолекуларне силе (индуковани дипол).
Написала Лириа Алвес
Дипломирао хемију
Бразилски школски тим
Види више!
Поларитет органских једињења
Органска хемија - Хемија - Бразил Сцхоол
Извор: Бразил Сцхоол - https://brasilescola.uol.com.br/quimica/temperatura-ebulicao-dos-compostos-organicos.htm
