Оксидација енергије у алкини је органска реакција која се јавља када се у кисели раствор дода алкин (угљоводоник који има троструку везу између два угљеника) реагенс од баеиер (Калијум перманганат - КМнО4).
НАПОМЕНА: Реакција оксидација енергије може се изводити са калијум-дихроматом (К2Цр2О.7), а не само калијум перманганат.
Кад год се реакција од врши се енергетска оксидација у алкинима, производи који могу бити пореклом су карбоксилне киселине, вода (једина ставка која се појављује у било ком од њих) и угљен-диоксид (ЦО2).
Баеиер реагенс у киселом медијуму
Када се Баеиеров реагенс помеша са водом, у присуству а киселина (супстанца способна за ослобађање Х јона+), формирање двоје оксиди (калијум оксид и манган оксид ИИ) и новонастали кисеоници ([О]).

Механизми оксидације енергије у алкинима
1. механизам: раскидање троструке везе.
У почетку, троструку везу нападају новонастали кисеоници формирани од Баеиеровог реагенса. Овај напад узрокује потпуно прекидање троструке везе.
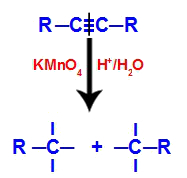
Прекид троструке везе нападом новорођених кисика
Када се тројна веза раскине, алкин се дели на два дела. На сваком од угљеника који су се троструко повезали појављују се три слободне валенције.
2. механизам: Интеракција хидроксилних група
Сваку од слободних валенци на угљеницима где је била трострука веза заузимају хидроксилне групе (ОХ), формирајући полиол (алкохол са неколико хидроксила).
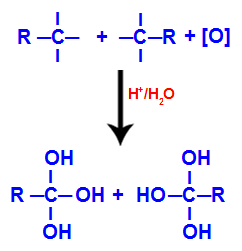
Стварање полиола са хидроксилним групама након цепања троструке везе
БЕЛЕШКА: Ако на угљенику где је некада била тројна веза, атом водоника је везан, тај атом водоника ће примити кисеоник у настајању и такође ће створити други хидроксил.
3. механизам: Стварање молекула воде
Када угљеник има две или више ОХ група, он постаје веома нестабилна структура због присуства изузетно електронегативи. Дакле, због нестабилности, молекул се подвргава самодехидрацији, односно хидроксил се везује за хидронијум (Х+) из другог хидроксила и образује воду.

Стварање молекула воде из два хидроксила присутна у формираном полиолу
4. механизам: Формирање производа
Након стварања молекула воде, угљеник губи везу услед изласка а хидроксил, а кисеоник другог хидроксила такође губи везу која је створена са водоник. Због тога се између овог угљеника и кисеоника појављује двострука веза која формира карбонил (Ц = О) и стабилизује обоје.
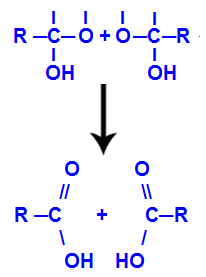
Формирање карбонила у две структуре добијене из алкина
Пример једначине оксидације енергије у алкинима
Пример: Енергетска оксидација Бут-1-ино
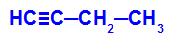
Структурна формула бут-1-ине
Када се бут-1-ине стави у медијум који садржи Баиер-ов реагенс, воду и киселину, веза се прекида. троструко постоји између угљеника 1 и 2, услед напада новонасталих кисеоника који постоје у средини, као у једначини доле:
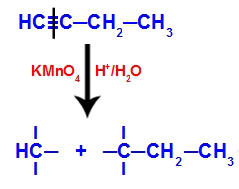
Прекид везе бут-1-ине
Након прекида троструке везе, угљеници 1 и 2 добијају три хидроксила, али угљеник 1 имаће још један јер имао је атом водоника (који се везује за кисеоник у настајању), формирајући два полиола (фрагменти 1 и 2).

Једначина која представља стварање полиола
Убрзо након што су полиоли нестабилни, из хидроксила настаје молекул воде. У фрагменту 1 појављује се молекул воде (јер постоје три хидроксила), а у фрагменту 2 два молекула (јер постоје четири хидроксила).
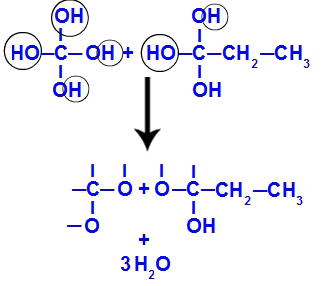
Формирање молекула воде из фрагмената бут-1-ине
Коначно, имамо двоструку везу између угљеника који су изгубили хидроксил и кисеоника који су изгубили водоник, што доводи до карбонила.

Формирање карбонила у фрагментима бут-1-ине
Помоћу горње једначине можемо видети да је бут-1-ин створио карбоксилну киселину и угљен-диоксид (ЦО2).
Ја сам, Диого Лопес Диас
Извор: Бразил Сцхоол - https://brasilescola.uol.com.br/quimica/oxidacao-energetica-alcinos.htm


