Можемо то приметити кад год повећамо концентрацију једног или свих реактаната који учествују у хемијској реакцији, долази до повећања његове брзине развоја, односно брзине реакције.
Тачно је и супротно. На пример, тренутно се препоручује да уместо уобичајеног алкохола користимо алкохолни гел, јер постоји мањи ризик од његовог сагоревања и на тај начин избегавања незгода. Обични течни алкохол је заправо мешавина алкохола и воде, са гел алкохолом који садржи мању количину алкохола. Стога, када се концентрација једног од реактаната сагоревања смањи, у случају алкохола, реакција се одвија спорије. С друге стране, што је алкохол чистији, реакција сагоревања је бржа.

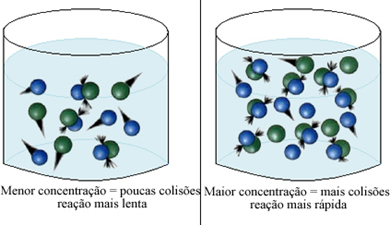
Као што је наведено у тексту Услови за појаву хемијских реакција, један од услова за реакцију је ефикасан судар између честица. Тако, повећање концентрације реагенса омогућава већу количину честица или молекула у истом простору. Ово повећава количину судара између њих и такође повећава вероватноћу да ће се догодити ефикасни судари који ће резултирати реакцијом. Резултат је да се реакција јавља брже.
Да бисте то видели, размислите о следећем примеру: када имамо жар који гори и желимо да се ово сагоревање брже обрађује, да ли дувамо или вентилирамо жар? Зашто ово ради?
Па, један од реактаната у овој реакцији сагоревања је кисеоник у ваздуху. Када се протресемо, ваздушна струја уклања пепео који настаје током сагоревања и то олакшава контакт кисеоника са жеравицом. На тај начин повећавамо контакт између реактаната и убрзавамо реакцију сагоревања.
Укратко, имамо:

Када се ради са гасовима, један од начина за повећање концентрације реактаната је смањите притисак. Када то урадимо, смањујемо запремину и, сходно томе, долази до повећања концентрација реагенса.

Јеннифер Фогаца
Дипломирао хемију
Извор: Бразил Сцхоол - https://brasilescola.uol.com.br/quimica/concentracao-dos-reagentes-velocidade-das-reacoes.htm
