ти естри су кисеонична органска једињења која настају хемијском реакцијом између а карбоксилне киселине то је алкохол. Представите функционалну групу (коју чине два атома кисеоника и два радикали Р) представљени у наставку:
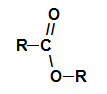
Општа функционална група естра
Структурно, оно што карактерише естер то је присуство неког алкил радикала везаног директно за атом кисеоника. У овом случају, радикал (Р) везан за угљеник - који је заузврат двоструко везан за кисеоник - може бити алкилни радикал или атом водоника.
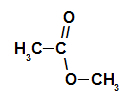
Угљенични ланац естра
реакција естерификације
ради се о хемијска реакција која доводи до естра и молекула воде из интеракције између карбоксилне киселине и било ког алкохола, као у доњој једначини:
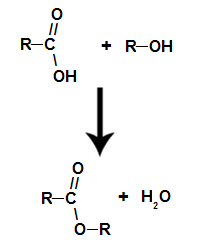
Хемијска једначина која представља настајање естра
Током естерификације, хидроксилна група (ОХ) алкохола ступа у интеракцију са водоник (Х) јонизујуће из хидроксила киселине и формира молекул воде.
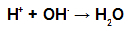
Групе које формирају молекуле воде у естерификацији
већ је естер настаје повезивањем радикала (Р) алкохола са кисеоником, који остаје од хидроксила киселине након стварања воде.
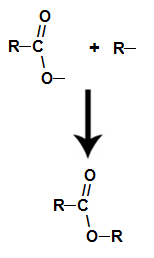
Стварање молекула естра
Карактеристике естара
Главна физичка својства представио естри:
Имају ароме воћа и цвећа;
ниски естри моларна маса течни су на собној температури, а они са великом моларном масом су чврсти;
У поређењу са алкохолима и карбоксилним киселинама, естри имају ниже тачке топљења и кључања;
У поређењу са водом, естри нижих моларних маса су мање густи;
Естери доње моларне масе су поларни, а неполарни већи моларне масе;
У поларним естрима превладавају силе стални дипол; у неполарним превладавају силе индуковани дипол;
Естри са мањом моларном масом су слабо растворљиви у води, а они веће масе нису растворљиви у води.
Правило именовања естера
Пре употребе правила именовања а естер, неопходно је запамтити да ово једињење настаје спајањем два дела, од којих један потиче карбоксилне киселине (у црвеној) и друге алкохола (у плавој), као што је приказано на слици а пратити:
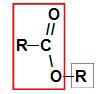
Идентификација делова који потичу од естра
Према Међународној унији за чисту и примењену хемију (ИУПАЦ), званично правило за именовање естра је:
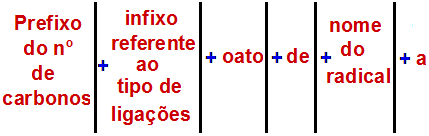
Правило именовања естера
Белешка: Префикс и инфикс увек одговарају делу карбоксилне киселине, а радикал алкохолном делу.
Погледајте испод неколико примера примене правила именовања за естре:
1. пример: суштина малине
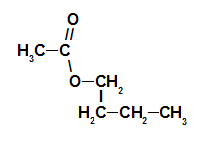
Структурна формула естра есенције малине
Да бисмо именовали овај естар, користимо:
Бр. ПрефиксО. угљеника: ет, јер киселина која формира има два угљеника;
Инфикс о типу веза: ан, јер формирајућа киселина има само једноструке везе између угљеника;
чин;
у;
Радикалан: бутил, јер имају четири угљеника у низу;
Тхе.
Дакле, назив естра који одговара суштини малине је бутил етаноат.
2. пример: есенција борове шишарке
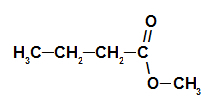
Структурна формула естра борове шишарке
Да бисмо формирали име овог естра, користимо:
Бр. ПрефиксО. угљеника: али, пошто формирање киселине има четири угљеника;
Инфикс о типу веза: ан, јер формирајућа киселина има само једноструке везе између угљеника;
чин;
у;
Радикалан: метил, јер алкохол који формира има само један угљеник;
Тхе.
Дакле, назив естра који одговара есенцији борове шишарке је метил бутаноат.
3. пример: есенција јагоде
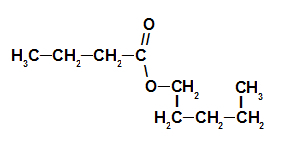
Структура структурне формуле есенције јагоде
Да бисмо именовали овај естар, користимо:
Бр. ПрефиксО. угљеника: али, пошто киселина која формира има четири угљеника;
Инфикс о типу веза: ан, јер формирајућа киселина има само једноструке везе између угљеника;
чин;
у;
Радикалан: пентил, пошто алкохол који формира има пет угљеника у низу;
Тхе.
Дакле, назив естра који одговара есенцији јагоде је пентил бутаноат.
Употреба естара
Естри су добро познати по својој употреби као арома у прерађеној храни, односно супстанцама које симулирају карактеристичан укус и арому природне хране, попут воћа. У наставку, естри се и даље користе у производњи лекова, козметике, парфема и воскова.
Ја сам, Диого Лопес Диас
Извор: Бразил Сцхоол - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-ester.htm