Теорија хибридизације појавила се као допуна Теорија октета, успевајући да објасни структуру већег броја молекула, укључујући молекуле формиране бором (Б).
Овај елемент има пет електрона у основном стању, са следећом електронском конфигурацијом:
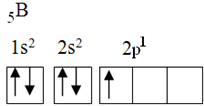
Према теорији октета, бор је могао да направи само једну ковалентну везу, јер има само једну непотпуну атомску орбиталу. Међутим, експериментално је примећено да овај елемент формира једињења у којима врши више од једне везе.
Пример је бор трифлуорид (БФ3). Као што је приказано доле, бор ствара три ковалентне везе са флуором, делећи три пара електрона и има шест електрона у последњој љусци (валентни слој), тј. изузетак од правила октет.
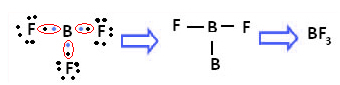
Ово се објашњава феноменом хибридизације који се јавља са бором. Испоставило се да електрон из поднивоа 2с апсорбује енергију и прелази у побуђено стање, у којем ускаче у празну орбиталу поднивоа 2п. На овај начин се формирају три непотпуне орбитале, које сада могу да направе три ковалентне везе:
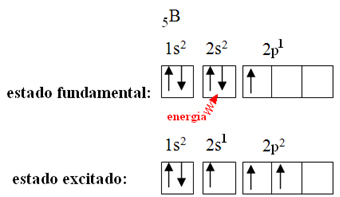
Међутим, везе настале у бор трифлуориду су све исте, али ако погледамо горе, постоје две везе различити, јер би један од њих био направљен помоћу с орбите, а друга два помоћу орбите тог типа. упишите стр. Овде се одвија хибридизација, односно непотпуне орбитале се стапају, дајући три
хибридне орбитале или хибридизован, који су идентични и разликују се од оригинала: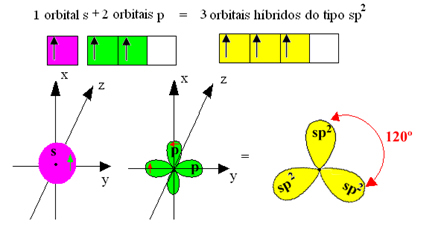
Пошто се ове хибридне орбитале састоје од једне с орбитале и две п орбитале, ова хибридизација се назива сп² хибридизација.
Флуор који се везује за бор има девет електрона. Његова електронска дистрибуција и орбитали приказани су у наставку:
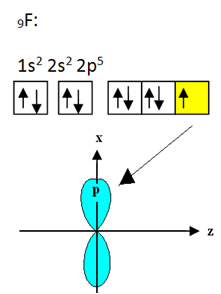
Имајте на уму да сваки атом флуора може да направи само једну ковалентну везу и да је орбитал који чини ову везу типа п. Дакле, посматрајте доле како се формирају орбитале приликом успостављања веза које чине БФ3 и видите како су везе идентичне, на пример σп-сп2:
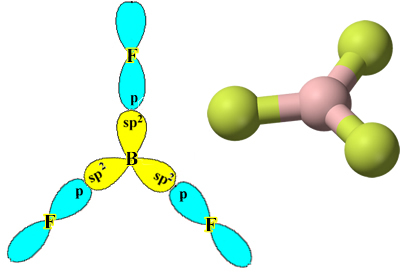
То се дешава и са другим елементима, види, на пример, текст „Хибридизација берилија”.
Јеннифер Фогаца
Дипломирао хемију
Извор: Бразил Сцхоол - https://brasilescola.uol.com.br/quimica/hibridizacao-boro.htm


