Реакције оксидације-редукције које се јављају у присуству водоник-пероксида (водени раствор водоник-пероксида - Х.2О.2 (ак)) представљају посебан случај који се мора анализирати одвојено, углавном у погледу његове равнотеже. То је зато што кисеоници у водоник-пероксиду, који имају Нок једнак -1, могу или оксидирати или смањити.
На пример, погледајмо два случаја у којима се понаша прво као оксидационо средство (редукционо), а затим као редукционо средство (оксидирајуће):
- оксидационо средство: кад год се водоник-пероксид редукује, делујући као оксидационо средство, ствара воду као производ.
Ако раствор водоник-пероксида додамо раствору који садржи јодидне јоне (И-) у киселом медијуму имаћемо:
Х.2О.2 (ак) + И-(овде) + Х+(овде) → Х.2О.(1) + И2 (с)
Уверите се да настају вода и јод. Али да бисте проверили да ли је водоник-пероксид заиста деловао као оксидационо средство и смањио се, посматрајте одређивање оксидационих бројева (НОк): *

Кисеоник Нок водоник-пероксида смањио се са -1 на -2, с обзиром да је примио 1 електрон. Међутим, како имамо по два кисеоника у сваком молекулу водоник-пероксида (Х
2О.2), варијација Нок ће бити једнака 2.Дакле, као што је приказано у тексту „Редокс балансирање”, Неопходан корак за уравнотежење реакција редокс методом је инверзија вредности Нок варијација помоћу коефицијената, у овом случају, како следи:
* Х.2О.2 = 2 (окНок) = 2 → 2 биће коефицијент И-;
* Ја-= ∆Нок = 1 → 1 биће коефицијент Х2О.2.
Тако имамо:
1 сат2О.2 (ак) + 2 И-(овде) + Х+(овде) → Х.2О.(1) + И2 (с)
Постизање осталих коефицијената балансирањем по огледима:
- С обзиром да се у првом члану налазе два атома кисеоника, коефицијент воде у другом члану мора бити једнак 2. А пошто у првом члану постоје и два јодидна јона, коефицијент јода у другом члану биће 1. Не заборавите да индекс морамо помножити са коефицијентом да бисмо пронашли тачну количину атома и јона у сваком члану:
1 сат2О.2 (ак) + 2 И-(овде) + Х+(овде) → 2 Х.2О.(1) + 1 И2 (с)
- Сада остаје само да се уравнотежи катион водоника 1. члана, а његов коефицијент мораће бити једнак 2, јер у 2. члану има 4 водоника, а у 1. члану већ има два:
1 сат2О.2 (ак) + 2 И-(овде) +2 Х+(овде) → 2 Х.2О.(1) + 1 И2 (с)
- редукционо средство: кад год водоник-пероксид оксидира, делујући као редукционо средство, он ствара кисеоник (О2) као производ.
Пример смањења водоник-пероксида је када дође у контакт са калијум-перманганатом (КМнО4). Ова супстанца има врло карактеристичну љубичасту боју, али када дође у контакт са водоник-пероксидом постаје безбојна. То је зато што је сав манган присутан у јону МнО4- раствора перманганата се редукује, што доводи до појаве јона Мн2+, како је приказано испод:
+1 -1 +7 -2 +1 0 +2 +1 -2
Х.2О.2 + МнО4-+ Х+ → Тхе2 + Мн2++ Х2О.
Израчунавајући Нок, видимо да кисеоник у водоник-пероксиду заправо оксидира и узрокује смањење мангана:
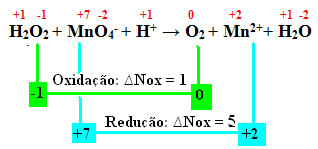
Као у претходном примеру, окБрој водоник-пероксида биће једнак 2, јер постоје два кисеоника и сваки губи електрон. Стога имамо:
* О.2 = 2 (окНок) = 2 → 2 биће коефицијент МнО4-;
* МнО4- = ОкНок = 5 → 5 биће коефицијент О.2.
И као и сви О.2 потиче од водоник-пероксида, две супстанце имају исти коефицијент:
5 Х.2О.2 + 2МнО4-+ Х+ → 5 О.2 + Мн2++ Х2О.
Балансирајући пробном методом, имамо:
5 сати2О.2 + 2 МнО4-+ 6 Х.+ → 5 О.2 + 2 Мн2++ 8 Х.2О.
* За сва питања о томе како израчунати оксидациони број (Нок) атома и јона у реакцији, прочитајте текст „Одређивање оксидационог броја (Нок)“.
Јеннифер Фогаца
Дипломирао хемију
Извор: Бразил Сцхоол - https://brasilescola.uol.com.br/quimica/reacoes-oxirreducao-envolvendo-agua-oxigenada.htm
