Једно пуферски раствор је смеша која се користи за спречавање промене пХ или пОХ медијума када се додају јаке киселине или јаке базе.
Постоје две врсте пуферског решења:
1. Смеша слабе киселине са њеном коњугованом базом;
2. Смеша слабе базе са коњугованом киселином.
Погледајмо примере сваког од њих и како они функционишу када се у подлогу дода мала количина јаке киселине или базе:
1. Смеша слабе киселине са њеном коњугованом базом:
Да би се добио такав раствор, слаба киселина се помеша са сољу истог ањона као и киселина.
На пример, размотрите пуферски раствор који се састоји од сирћетне киселине (Х3ЦЦООХ(овде)) и натријум ацетата (Х.3ЦЦООНа(с)). Уверите се да обоје имају ацетат анион: (Х3ЦЦОО-(овде)). Концентрација ових јона је практично последица дисоцијације соли која је велика. Јонизација киселине је мала.

Сада уочите шта се дешава у следећим могућностима додавања:
- Додатак мале количине јаке киселине:
Додавањем јаке киселине повећава се концентрација јона хидронијума, Х.3О.+1, а пошто је сирћетна киселина слаба киселина, ацетатни анион има висок афинитет за протоне (Х
+) хидронијум. На тај начин они реагују и ствара се више сирћетне киселине:
Као резултат, пХ средине се практично не мења. Међутим, ако се дода све више и више јаке киселине, доћи ће време када ће се потрошити сав ацетат анион и ефекат пуферирања ће престати.
- Додатак мале количине јаке базе:
Додавањем јаке базе повећава се концентрација ОХ јона-. Али ови јони су неутрализовани са јонима Х.3О.+1 ослобођени у јонизацији сирћетне киселине:

Овом реакцијом концентрација Х јона3О.+1(овде) ће се смањити и доћи ће до померања равнотеже у смислу повећања јонизације киселине и, према томе, варијација пХ раствора ће бити врло мала. Концентрација јона Х3О.+1(овде) биће практично константно.
У овом случају постоји и ограничени капацитет. Стога, ако додамо све више и више базе, равнотежа јонизације киселине ће се све више померати ка њеној јонизацији, све док се не потроши сва киселина.
2. Смеша слабе базе са коњугованом киселином:
Ова врста пуферског раствора састоји се од слабе базе и раствора соли који садрже исти катион као и база.
На пример, размотрите пуферски раствор који формира магнезијум хидроксид, МгОХ2 (ак) (слаба база) и магнезијум хлорид, МгЦл2 (с) (со). Оба садрже катион магнезијум (Мг2+(овде)). Јони магнезијума присутни у медијуму су практично сви изведени из дисоцијације соли, јер је дисоцијација базе слаба:
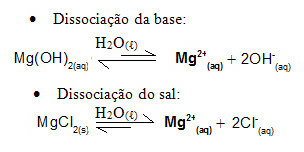
- Додатак мале количине јаке киселине:
У овом случају, јони Х.3О.+1 који долазе од додавања јаке киселине биће неутрализовани јонима ОХ-, који долази од слабе дисоцијације базе. Ово ће померити основну равнотежу дисоцијације удесно.
Тако ће варијација пХ (ако постоји) бити врло мала, јер је концентрација ОХ јона- остаје константан. Ефекат пуферирања ће престати када се раздвоји читава база.
- Додатак мале количине јаке базе:
Додата јака база пролази кроз дисоцијацију ослобађајући јоне ОХ-. Пошто је магнезијум хидроксид слаба база, магнезијум ослобођен дисоцијацијом од соли имаће већу тенденцију да реагује са ОХ-:

Према томе, повећање јона ОХ- надокнађује се пропорционалним повећањем Мг (ОХ)2 (ак). Као резултат, пХ не пролази кроз веће промене.
Овај ефекат престаје када се потроши сав катион магнезијума.
Јеннифер Фогаца
Дипломирао хемију
Извор: Бразил Сцхоол - https://brasilescola.uol.com.br/quimica/o-que-uma-solucao-tampao.htm

