Алуминијум се добија металуршким процесима. Металургија је подручје које проучава трансформацију руда у метале или металне легуре. Овом методом добија се неколико метала, попут бакра, титана, гвожђа и мангана.
У случају алуминијума, главна руда која се користи је боксит (слика), који садржи хидратисани алуминијум-оксид (Аℓ2О.3. к Х2О) и разне нечистоће.

У металургији алуминијума одвијају се следећа четири корака:
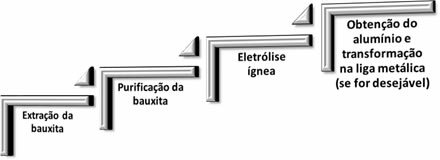
Када оксид алуминијума (Аℓ2О.3 (с)) одваја се од боксита, његово име постаје глинице.
Претходно је урађено следеће: глиница је обрађена хлороводоничном киселином да би се добио алуминијум хлорид; који је постављен да реагује са металним калијумом или натријумом, узрокујући редукцију једињења и дајући метални алуминијум:
Аℓ2О.3 (с) + 6 ХЦℓ(овде)→ 4 АℓЦℓ3 (ак) + 3 Х.2О.(ℓ)
АЦℓ3 (ак) + 3К(с)→ 3 КЦℓ(с) + Аℓ(с)
Међутим, овај метод је био врло скуп и неефикасан, па се алуминијум сматрао ретким металом.
Али 1886. године два научника су одвојено развила горе поменуту методу, у којој је коришћена магматска електролиза. Ти научници су били Американац Чарлс М. Халл и Француз Паул Хероулт, зато је и названа ова метода
Халл-Ероултов процес или једноставно,Процес Халл, док је Цхарлес М. Халл га је патентирао.Кључна ствар коју су открили било је како направити течност од алуминијумског оксида. бити у стању да изврши своју магматску електролизу, јер је проблем био што је тачка топљења била изнад 2000 ° Ц. Користили су флукс, криолитну руду (На3АℓФ6), који је успео да спусти температуру топљења алуминијумског оксида на око 1000 ° Ц.
Тако је, као што је приказано на доњем дијаграму, ова смеша алуминијумског оксида и криолита стављена у електролитску посуду обложену угљеником. Кроз ову растопљену смешу пролази електрична струја. Зидови контејнера који су у контакту са смешом делују као негативни пол електролизе (катода), где долази до смањења катјона алуминијума. Анода (позитивни пол) су цилиндри направљени од графита или угљеника, односно оба од угљеника, где долази до оксидације ањона кисеоника:
Полуреакција катоде: 4 Аℓ3+(ℓ) + 12 и- → 4 Аℓ(ℓ)
Полуреакција аноде: 60 О.2-(ℓ) → 12 и- + 3 О.2 (г)
Настали кисеоник реагује са угљеником у аноди и такође ствара угљен-диоксид:
3 О.2 (г) + 3 Ц.(с) → 3 ЦО2 (г)
Дакле, укупна реакција и шема ове магматске електролизе која доводи до настанка алуминијума дају се:

Добијени алуминијум је у течном облику, јер је његова тачка топљења 660,37 ºЦ, односно нижа од температуре мешавине глинице и криолита. Алуминијум је такође густији од смеше и зато се одлаже на дно посуде, где се сакупља.
У производњи 1 тоне алуминијума користи се:
- 4 до 5 тона боксита, одакле о 2 тоне глинице;
- 50 килограма криолита (нема много природних резерви криолита, стога се обично добија његовом синтезом из флуорита (ЦаФ2), најзаступљенији минерал у природи);
- 0,6 тона угља за електроде.
Годишње производња алуминијума премашује 27,4 милиона тона.
Међу главним легурама алуминијума имамо следеће:

Јеннифер Фогаца
Дипломирао хемију
Извор: Бразил Сцхоол - https://brasilescola.uol.com.br/quimica/obtencao-aluminio-por-meio-eletrolise.htm
