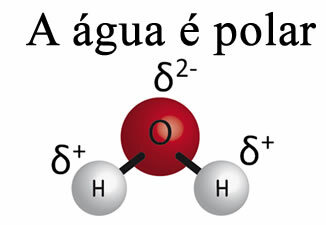
Вода сама не може уклонити масноћу са материјала. То је зато Тхевода је поларна, као што је приказано на слици испод, због разлике у електронегативности која постоји између атома водоника и кисеоника њихових молекула. С друге стране, маст је неполарна и зато вода не раствара масти.
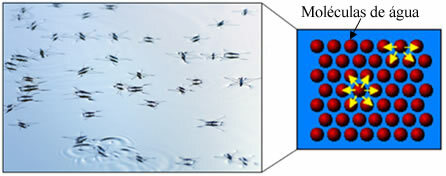
Поред тога, вода има нешто што се зове површна напетост. Ово можете боље разумети у тексту. Површинска напетост воде, али у основи је то врста еластичног филма или мембране која се формира на површини воде, што спречава њено продирање у тканине и друге материјале ради уклањања прљавштине. Молекули воде привлаче једни друге у свим правцима водоничне везе, али површински молекули делују само са молекулима са стране и одоздо, стварајући разлику у кохезионе снаге, што доводи до контракције површинских молекула и формирања ове површинске напетости.
Ту долазе сапуни и детерџенти (од латинског детоксификовати = цлеар), који се такође називају површински активна средства, јер имају способност да смање површински напон воде и, поред тога, комуницирају и са водом и са мастима. Како се ово дешава?
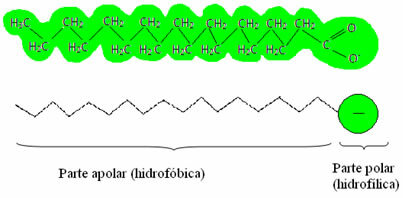
Сапуни и детерџенти имају соли масних киселина, које су дугачки молекули формирани од а неполарни део (шта је хидрофобни – хидро = вода; фоби = аверзија) и а поларни крај (хидрофилни – хидро = вода; пхила = пријатељ). Испод имамо типичну структуру сапуна:
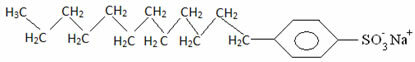
Генерално, детерџенти су соли дуголанчаних сулфонских киселина:
Дакле, неполарни део ових молекула присутних у сапунима и детерџентима комуницира са мастима, док поларни крај комуницира са водом, групишући се у мале глобуле, позвао од мицеле, у којем су хидрофилни делови окренути према спољашњој страни мицеле у контакту са молекулима воде, и масноћа остаје изнутра, у контакту са неполарним или хидрофобним делом, поступак сличан ономе приказаном на слици а пратити:
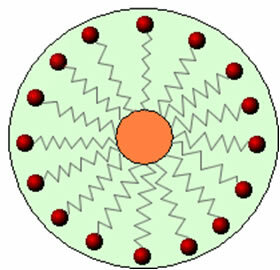
На тај начин се масна прљавштина зароби у средиште мицела и може се уклонити. Друга ствар је да детерџенти и сапуни имају способност да смање површински напон воде, јер смањити интеракције између његових молекула, чинећи тако лакшим продирање кроз разне материјале ради уклањања прљавштина.
Јеннифер Фогаца
Дипломирао хемију
Извор: Бразил Сцхоол - https://brasilescola.uol.com.br/quimica/quimica-dos-saboes-detergentes.htm


