ТХЕ стереоизомеризам, такође познат као Свемирска изомерија, је врста изомерије у којој се њени изомери разликују тако што су везе између њихових атома другачије распоређене у простору.
Постоје две врсте стереоизомера, дијастереоизомери и енантиомери. Дијастереоизомери су геометријски изомери цис-транс типа, који међусобно нису зрцалне слике, док су енантиомери оптички изомери који међусобно зрцално одражавају.
Говорећи мало о цис-транс диастереоизомер, јавља се само у једињењима која су незасићена или која су циклична. Зашто се то не дешава у засићеним ланчаним једињењима, односно која имају само једноструке везе између угљеника?
Може се десити да се збунимо, мислећи да су одређена засићена једињења дијастереоизомери, док у ствари представљају исто једињење. На пример, доле имамо три просторне конформације атома 1,2-дихлороетана:
Х Х Х Х Х Кл
│ │ │ │ │ │
Х. — Ц — Ц — ХХ — Ц — Ц — ЦлХ — Ц — Ц — Х.
│ │ │ │ │ │
Кл КлКл Х. Кл Х.
Да ли су ово три дијастереоизомера? Немој. Заправо, три молекула су истог једињења.
Оно што се дешава је да појединачне везе или сигма (σ) између угљеника могу да се ротирају, што резултира различитим атомским аранжманима.Погледајте како се то дешава у доњој шеми са етаном:

Ова једињења, која су заправо иста једињења, не изводе геометријску цис-транс изомерију, али су тзв конформационих изомера, јер се разликују само у конформацији њихових атома изазваној ротацијом око једноструке везе.
Један од начина да се ови молекули представе како би се лако визуализовала ротација осовине везе је кроз Невманова пројекција, у којем се сматра као да се раван вида налази тачно на оси везе између угљеника и они су представљени централним кругом. Погледајте Невманову пројекцију за етан:

Те различите конформације такође можемо представити кроз формула на штафелајима:
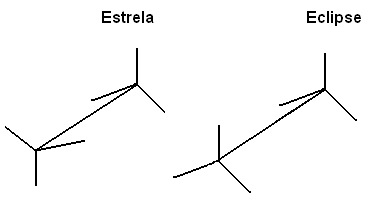
Ова слободна ротација осовине везе више се не дешава у незасићеним једињењима или у цикликама. На пример, замислите да градимо једноставан модел, који представља два угљеника помоћу две куглице стиропора повезане чачкалицом забоденом у њих.
Када имамо једну чачкалицу и држимо једну куглицу, друга се лако може окретати око своје осе, баш као што то чини једноставним везивањем.

Међутим, ако поставимо још једну чачкалицу која повезује две сфере, нећемо моћи да држимо једну сферу, а да ротирамо другу. Ако то учинимо, чачкалице ће се сломити. Исто тако, када постоје пи веза и сигма (двострука веза), постоји препрека за ротацију угљеника.
Према томе, у доњем случају, у којем имамо двоструку везу између угљеника, није реч о два конформациона изомера, односно две конформације за исти молекул; заправо имамо два цис-транс дијастереоизомера:
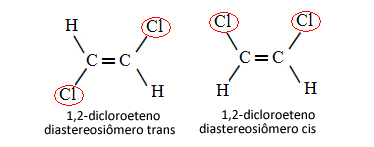
О овој врсти изомерије погледајте више у тексту Геометријски или цис-транс изомери.
Јеннифер Фогаца
Дипломирао хемију
Извор: Бразил Сцхоол - https://brasilescola.uol.com.br/quimica/isomeria-conformacional.htm

