У Међумолекуларне снаге то су електростатичке привлачне силе чија је функција обједињавање молекула (молекуларних једињења), одржавајући их у чврстом или течном стању. Изузетно су важни, јер одређују сва физичка својства (тачка топљења, тачка кључања, густина и растворљивост) супстанци.
У овом тексту ћемо проучити однос између интермолекуларних сила и тачке кључања супстанци. У почетку, подсетимо се на три важне врсте интермолекуларних сила, а то су:
♦ дипол дипол: је сила која се јавља у поларним молекулима. С обзиром да ови молекули имају позитиван и негативан пол, дипол-дипол сила заснива се на привлачењу између позитивног краја једног молекула и негативног краја другог. Примери: ХЦл, ХБр, СО2 и ПХ3
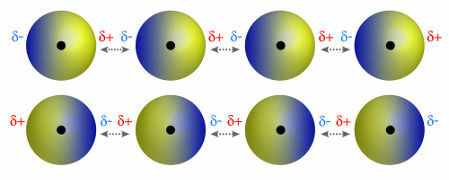
Молекули који имају позитиван и негативан пол привлачећи једни друге
♦ Индуковани дипол: је интермолекуларна сила која се јавља само у неполарним молекулима (они немају полове). Када се приближе два аполарна молекула, долази до тренутне деформације њихових облака електрона, што узрокује неравнотежу у електронима молекула, који су распоређени у другачији за њу. У том тренутку се ствара тренутни дипол и молекул тренутно има позитивни и негативни пол, што узрокује привлачење. Примери: ЦО
2, ЦХ4 и бх3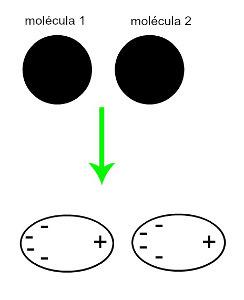
Приближавање два неполарна молекула генерише деформацију и, сходно томе, прерасподелу електрона, што ствара тренутне диполе
♦ Водоничне везе: то је интермолекуларна сила која се јавља у поларним молекулима, али само код оних који имају атоме водоника обавезно повезане директно са атомима флуора, кисеоника или азота. Може се сматрати дипол-диполном силом, али много већег интензитета. Интеракција се увек одвија између водоника једног молекула и другог атома (Ф, О, Н) другог молекула. Примери: Х.2О, НХ3 и ХФ
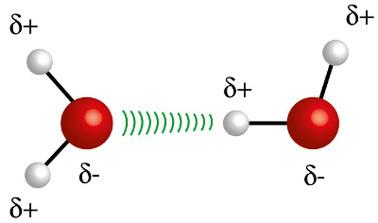
Атом водоника (бела сфера) једног молекула делује у интеракцији са кисеоником (црвена сфера) другог молекула воде
Присетивши се три интермолекуларне силе, сада их можемо повезати са тачком кључања супстанци. се зове тачка кључања температура на којој молекули дате супстанце престају да буду у течном стању (прекидају се њихове интермолекуларне силе) и прелазе у гасовито стање. Занимљив детаљ је да интермолекуларне силе и тачка кључања супстанци имају врло интензиван и директан однос, јер што је интермолекуларна сила интензивнија, тачка кључања је већа. Редослед интензитета интермолекуларних сила је:
Индуковани дипол
Дакле, можемо закључити да молекули који имају водоничну везу као силу интеракције имају веће тачке кључања од оних који имају дипол-дипол и тако даље. Табела у наставку приказује три супстанце и њихове вредности тачке кључања:
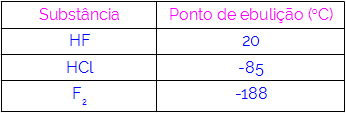
У табели примећујемо да ХФ има вишу тачку кључања, пошто су његови молекули повезани водоничним везама. Супстанца Ф.2 има најнижу тачку кључања, пошто њене молекуле привлачи индуковани дипол.
Ја сам, Диого Лопес Диас
Извор: Бразил Сцхоол - https://brasilescola.uol.com.br/quimica/forcas-intermoleculares-ponto-ebulicao-das-substancias.htm

