Киселине и базе су две врсте корозивних супстанци, али се сматрају хемијским супротностима.
Једна од највећих разлика између киселина и база је у томе што базе, у контакту са воденим раствором, ослобађају негативне јоне, хидроксиле (ОХ-). Киселине, у контакту са водом, ослобађају позитивне јоне водоника (Х+).
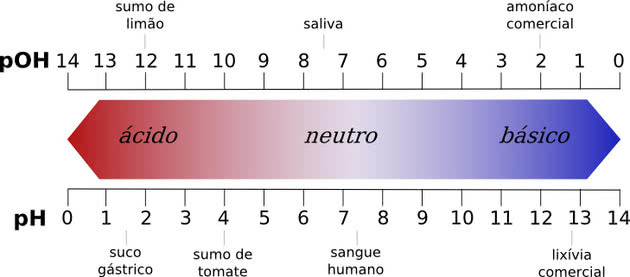
Свака супстанца са пХ вредношћу између 0 и 7 сматра се киселом, док пХ вредност од 7 до 14 је базна. Вредност 7 је неутрална, што одговара води.
| Киселине | Басес | |
|---|---|---|
| Дефиниција Аррхениуса | Киселина је свако хемијско једињење које у воденом раствору ослобађа јоне водоника (Х+). |
База, или алкалија, је супстанца која, у воденом раствору, ослобађа хидроксил, негативне јоне (ОХ-) |
| Дефиниција Бронстед-Ловрија | Киселина је супстанца која даје протон. | База је свака супстанца која прихвата протон. |
| дефиниција Луиса | Током хемијске везе, киселине су те које примају електронске парове. | У хемијској вези, базе су оне које донирају електронске парове. |
| пХ вредност | Мање од 7,0. | Више од 7,0. |
| Физичке карактеристике | Киселине се могу појавити у чврстом, течном или гасовитом облику, у зависности од температуре. | Често чврста осим амонијака који је гас. |
| Структура | Киселине су молекуларне, односно формиране ковалентним везама у којима се деле електрони. | Базе могу бити јонске или молекуларне. |
| хемијска формула | Киселине имају хемијску формулу са Х на почетку, на пример, ХЦл (хлороводонична киселина). Сирћетна киселина (сирће) је изузетак, са ЦХ3ЦООХ. | Базе имају ОХ на крају своје формуле, на пример НаОХ (натријум хидроксид). |
| Растворљивост у води | Имају тенденцију да буду прилично растворљиви у води. | Већина база је практично нерастворљива. |
| Реакција на индикатор фенолфталеина | Остаје безбојан. | Направите раствор ружичасте боје. |
| Пх тест (са лакмус папиром) | Поцрвени. | Постаје плаво. |
| Електрична проводљивост | Они проводе струју само када су растворени у води. | Они такође проводе електричну струју у воденом раствору. |
| Примери | Сирћетна киселина, сумпорна киселина. | Натријум хидроксид, амонијак |
Шта су киселине и базе
Киселине су јонска једињења која када се растворе у води стварају позитиван јон водоника (Х+). Базе су, с друге стране, јонска једињења која формирају негативно наелектрисани хидроксидни јон (ОХ-) у води.
Ова дефиниција, коју је креирао шведски научник Сванте Аррхениус, најчешће се користи за класификацију киселина и база, међутим, постоје и друге дефиниције.
Дефиниција коју је дао Јоханнес Н. Бронстед и Томас Лоури, познати као дефиниција протона, кажу да су киселине супстанце које дају протон, док су базе оне које прихватају протон.
У дефиницији коју је дао северноамериканац Гилберт Њутн Луис, киселине су супстанце које примају електронске парове у хемијску везу, док базе одају парове.
пХ киселина и база
Сва хемијска једињења имају пХ вредност, која може да се креће од 0 до 14, где бројеви представљају концентрацију водоничних јона у раствору.
Неутрални пХ је пХ чисте воде, који је 7. Свака супстанца са пХ вредношћу између 0 и 7 сматра се киселом, док пХ вредност од 7 до 14 је базна.
Што је киселина нижа испод 7,0, то је јача. У базама, што је већа пХ вредност, то ће бити јача.
Карактеристике киселина:
- Има горак укус;
- Може запалити кожу када се додирне;
- Може кородирати метале и кожу;
- Чини лакмус папир црвеним;
- У универзалном индикатору се идентификује црвеним или наранџастим бојама.
Карактеристике база
- адстрингентни укус;
- Када додирнете, осећате нешто вискозно;
- Многе базе реагују са киселинама и стварају соли;
- Јаке базе могу бурно да реагују са киселинама;
- Основе постају плаве боје лакмус папира;
Индикатори киселина и база
пХ индикатори, или кисело-базни индикатори, су супстанце које се користе да би се утврдило да ли је раствор киселина или база.
То је могуће због његових физичко-хемијских својстава, која имају способност да мењају боју према пХ вредности испитиване супстанце.
Међу многим вештачким индикаторима који се користе у лабораторији, најпознатији су фенолфталеин, лакмус папир и универзални индикатори.
- Фенолфталеин остаје безбојан у контакту са киселином, а постаје ружичаст у додиру са базама.
- Лакмус папир постаје плав са базама и црвен са киселинама.
- Универзални индикатор је најтачнији од киселинско-базних индикатора јер показује различите боје према свакој пХ вредности.

Примене киселина и база у свакодневном животу
Киселине се често користе за уклањање рђе са метала, као електролит у батеријама, за прераду минерала, за производњу ђубрива и бензина и као адитива у храни и пића.
Базе се првенствено користе за чишћење, као што су детерџенти за прање судова и сапун за прање веша, средства за чишћење пећница и средства за уклањање мрља.