ТХЕ франциум, симбол Фр, атомски број 87, је елемент који припада групи 1 Периодни систем, алкални метали. Међутим, за разлику од осталих елемената групе, францијум нема стабилне изотопе, што је чак отежавало његово откриће. У ствари, францијум је био последњи елемент који треба открити и изоловани у природним узорцима.
Његова велика атомска нестабилност не дозвољава да се добију видљиви и тешки узорци, па се његове физичко-хемијске особине екстраполирају из података других алкалних метала. Процењује се да у земљиној кори има само 30 грама францијума, што га чини други најређи елемент на планети, иза само астатина.
Прочитајте такође: Рубидијум — елемент који се користи у производњи специјалних наочара и атомских сатова
франциум суммари
Францијум је алкални метал који се налази у седмом периоду периодног система, симбол Фр, З = 87.
Нема стабилне изотопе и други је најређи елемент на планети.
Његов најстабилнији изотоп има време од полу живот 22 минута.
То је елемент са највећим атомски зрак периодног система, поред тога што је најелектропозитивнији.
Може се добити само нуклеарним процесима, тешко га је изоловати.
Још увек нема практичних примена везаних за францијум.
Франциум Пропертиес
Симбол: Фр.
атомска маса: 223.02 у.
Фусион поинт: 22°Ц (процењено).
Тачка кључања: 665 °Ц (процењено).
Густина: 2,5 г/цм³ (процењено).
електронегативност: 0,79.
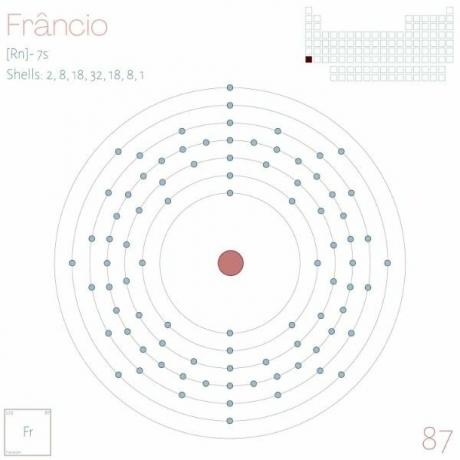
Електронска дистрибуција: [Рн] 7с1.
→ Видео лекција о периодичним и апериодним особинама хемијских елемената
Францијумске карактеристике
тхе франциум има неколико изотопа, али изотоп 233 је најстабилнији, достижући полуживот од 22 минута. Само изотоп 212 има слично време полураспада од 21 минут, док се остали не приближавају томе, а можда чак имају и време полураспада реда неколико секунди.

све ово атомска нестабилност отежава одређивање важних физичких карактеристика и својстава. У ствари, позната својства су добијена у екстремним условима. разблаживање (концентрација реда 10-15 мол/Л).
Као алкални метал, познато је да је његов оксидациони број +1. Експерименти су такође показали да францијум је највећи елемент електропозитивна периодног система. Друга водећа позиција коју овај елемент има у табели је онај са највећим пречником, са 2,7 ангстрема (10-10 м).
Као и други алкални метали, францијум остаје у раствору док се остали елементи таложе у облику хидроксида, карбоната, флуорида, сулфида, хромата итд.
Прочитајте такође: Шта су радиоактивни елементи?
Добијање францијума
Францијум-223, најстабилнији изотоп Фр, био је први пут откривен кроз алфа емисију актина-227. Такође је могуће произвести францијум (изотоп 212) бомбардовањем злато (197Ау) са кисеоником-18 (18О) у нуклеарном реактору.
Францијум се може добити на више начина. На пример, постоји могућност преципитације са цезијум, кроз соли тешко растворљиви елементи као што је перхлорат (ЦлО4-), хексахлороплатинат (ПтЦл62-), јодат (ИО4-), између осталих. Међутим, очекује се да ће одвајање цезијума и францијума бити веома тешко.
Друге методе развијене 1960-их и 1970-их дозвољавале су одвајање францијума од раствора цезијума и рубидијума преко катјонских измењивачких смола. Францијум-223, који је откривен из алфа емисије актинијума-227, такође се може одвојити од актинијума и других производа разградње селективним техникама преципитације. Постоји и друга техника која се користи са релативним успехом: сублимација францијум хлорида (ФрЦл) на температурама око 300 °Ц.
Примене францијума
Тестови на пацовима су закључили да се францијум акумулира у бубрезима, јетри и пљувачним жлездама. Поред тога, било је покушаја да се примени у нуклеарној медицини, у дијагностици карцинома, али је тешкоћа у припреми и изоловању учинила пројекат неизводљивим. Ова карактеристика, додата његовом ниском полуживоту, чини францијум један од ретких елемената нема практичне примене.
Међутим, чињеница да је највећи атомски радијус периодног система и има само један електрон у валентни слој неке истраживаче држи радозналим о његовој природи. Године 2002. група истраживача у Сједињеним Државама успела је да ухвати 300.000 атома францијума да би сазнала више о елементу.
Погледајте наш подцаст: Чврст као дијамант: шта то значи?
историја франција
Оно што се истиче у историји францијума је број пута када су људи рекли да су га открили након тога Мендељејев предвиђа постојање овог елемента 1871. године, под именом ека-цезијум.
Одавно је познато да после елемента 83, бизмута, периодни систем показује само радиоактивне и нестабилне елементе — са изузецима као што су уранијум и торијум. Чак и тако, ово није обесхрабрило многе научнике да траже елемент 87 у природним изворима и, чешће него не, тврде да су открили.

На пример, 1925. руски хемичар Добросердов је приметио слаб радиоактивност у узорку од калијум, закључивши да би то био елемент 87 и дајући му име русија, у част своје родне земље. Ипак, најбоље објашњење за ту чињеницу било је то што је, у ствари, откривена радиоактивност изотопа. 40К, бета емитер који чини око 0,012% природног калијума.
Године 1926, енглески хемичари Друс и Лоринг, када су анализирали спектралне линије манган (ИИ) сулфата, такође су претпоставили да посматрају неке линије које се односе на елемент 87, за који су касније предложили Име алкалијум. Међутим, слабост доказа обесхрабрила је истраживаче да крену напред.
Затим, 1930. године, Фред Алисон је тврдио да је открио елемент 87 након неких експеримената са узорцима полуцита (руде богате цезијумом) и лепидолита (руде са литијум у свом саставу). Алисон је предложила име виргиниум у част америчке државе Вирџиније. Међутим, 1934. године Макферсон је показао нетачности у Алисоновом открићу.
Две године касније, Жан Перин, француски физичар за који се зна да је потврдио Ајнштајнову теорију Брауновског кретања, обезбеђујући, тако, довољан доказ за постојање атома, придружио се римском физичару Хорију Хулубеју у серији експеримената са зрацима ИКС. Затим су добили очекиване резултате за елемент 87, који су одмах назвали молдавиум, у односу на регион Молдавије, родно место Хулубеја. Међутим, опет, дело је критиковано у светлу тумачења.
Нико од истраживача није могао да разуме, али оно што се догодило је да францијум има веома нестабилне изотопе, са веома кратким полуживотом. Несрећа је била таква да чак се разматрало непостојање елемента 87.
Међутим, 1939. године, откриће елемента 87 догодило се од стране некога ко је почео као лабораторијски асистент ником другом осим Марие Цурие, у Паризу: Тхе француска Маргуерите Переи. Са добром стручношћу у руковању и пречишћавању радиоактивних узорака, Переи је добио задатак да анализира радиоактивни узорак актинијума, елемента 89.
научник био је први који је приметио алфа и бета емисије које производи актинијум, откривајући нови елемент са временом полураспада од 21 минут. Францускиња је тада опрезно објавила своје откриће и 1946. одбранила докторску тезу Елемент 87: актинијум-К.
Нови елемент је тада назван францијум, у част своје матичне земље, у почетку са Фа симболом. Године 1949 Међународна унија чисте и примењене хемије (Иупац) потврдила је елемент са именом које је дао Переи, али је 1951. променио симбол у о.
Решене вежбе о францијуму
Питање 1
Францијум (Фр, З = 87) је алкални метал са кратким временом полураспада и нестабилан је. Међутим, познато је да има нека својства слична другим алкалним металима.
На основу горњих информација, које је једињење вероватно формирано између францијума и брома (Бр, З = 35)?
А) ФрБр2
Б) о2бр
Ц) ФрБр
Д) ФрБр3
Одговорити
Францијум, као алкални метал, има НОКС једнак +1. Већ бром, а халоген, у одсуству кисеоника има НОКС једнак -1. Стога је највероватније једињење међу њима слово Ц, ФрБр.
питање 2
Атомски радијус је изузетно важно периодично својство, јер не само да разликује атоме у смислу њихове величине, већ такође помаже да се разумеју реактивност и друга својства атома.
Међу елементима периодног система, елемент који има највећи атомски радијус је:
А) Ф
Б) Цс
Ц) Х
Г) о
Е) Ог
Одговорити
Познато је да је атомски радијус већи што је већи период елемента и што је мањи број електрона у валентном слоју. Дакле, елемент са највећим радијусом је францијум, Фр, као што се налази у седмом периоду периодног система и има само један валентни електрон.
Аутор: Стефано Араујо Новаис
наставник хемије

