Алкохоли могу бити подвргнути оксидацији када су изложени оксидационом агенсу, као што је водени раствор калијум дихромата (К2Цр2О7) или калијум перманганат (КМнО4) у киселој средини.
Кисеоник у настајању [О] у средини ће напасти угљеник повезан са функционалном групом алкохола (хидроксил - ОХ), формирајући веома нестабилно једињење, названо твин диол, које има два хидроксила повезана са истим угљеник. Пошто је нестабилно, ово једињење ослобађа воду и ствара нови производ.
Овај производ ће зависити од врсте алкохола који је оксидован, било да је примарни, секундарни, терцијарни или метанол.
Укратко, имамо:
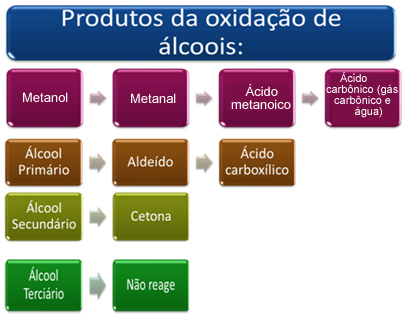
Погледајте сваки случај у наставку:
- Метанол (Х3Ц─ ОХ):
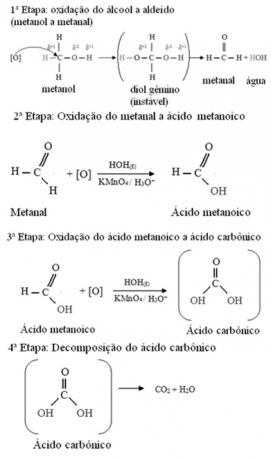
Метанол је једини алкохол који има три водоника везана за угљеник који ће бити подвргнут оксидацији. У овом случају, пошто постоје три тачке на молекулу које кисеоник у настајању може да нападне, доћи ће до три узастопне оксидације, као што је приказано на дијаграму испод:
- Примарни алкохоли:
У овим једињењима, хидроксилни угљеник је везан само за један атом угљеника, то јест, два друга лиганда су водоници, а постоје два места за напад кисеоника у настајању.
Прво ће доћи до формирања алдехида, као што је приказано у наставку:
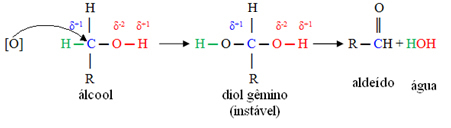
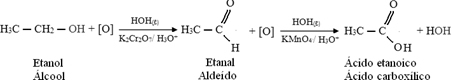
Али, оксидација се наставља, јер су реагенси који се користе за оксидацију алкохола јачи од оних који се користе за оксидацију алдехида. Затим, други кисеоник у настајању напада карбонил угљеник и производи карбоксилну киселину.
Следи пример, оксидација етанола, прво у етанал, а затим у етанску киселину (сирћетну киселину). Ова укупна реакција је трансформација вина у сирће.
Не заустављај се сада... Има више после реклама ;)
Делимична оксидација етанола у етанал настаје када алкохоличар уради тест алкотестом за једнократну употребу. Унутар овог уређаја налази се чврста мешавина калијум дихромата и силицијум диоксида у киселој средини, при чему долази до следеће реакције:
К2Цр2О7(ак) + 4Х2САМО4(ак) + 3 ЦХ3ЦХ2ох(г) → Кр2(САМО4)3(ак) + 7 ујутро2О(1) + 3 ЦХ3ЦХО(г) + К2САМО4(ак)
Орангеетанол (безбојан)зеленаетанал (безбојан)
Имајте на уму да, поред оксидације етанола (алкохола) у етанал (алдехид), постоји истовремена редукција дихромата, који је наранџасти, у хром (ИИИ), или чак хром (ИИ), који је зелен. Промена боје ће указати на то да особа има више алкохола у крви него што је дозвољено.
- Секундарни алкохоли:
То су једињења у којима је хидроксилни угљеник везан за два друга атома угљеника и само један атом водоника. Дакле, постојаће само једна локација у молекулу где кисеоник у настајању може да нападне и формираће се само једна врста производа, који ће увек бити кетон:
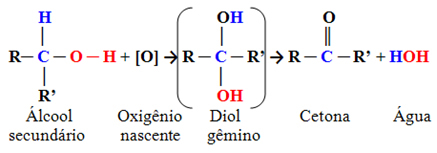
Пошто карбонил угљеник кетона нема водоник директно везан за њега, више не постоји могућност даље оксидације. Стога се реакција зауставља на кетону.
- Терцијарни алкохоли:
Терцијарни алкохоли су они у којима угљеник који има -ОХ групу прави три везе са другим атомима угљеника. Пошто се не везују за водонике, нема тачке на молекулу која може бити нападнута кисеоником у настајању. Због ове чињенице терцијарни алкохоли не подлежу оксидацији.
* Извор и аутор слике: ЦостаПППР.
Аутор: Јеннифер Фогаца
Дипломирао хемију
Да ли бисте желели да референцирате овај текст у школском или академском раду? погледај:
ФОГАЦА, Јеннифер Роцха Варгас. "Оксидација алкохола"; Бразил школа. Доступна у: https://brasilescola.uol.com.br/quimica/oxidacao-dos-alcoois.htm. Приступљено 27. јула 2021.
хемија

Како ради алкотест, концентрација алкохола, алкотест, реакције које укључују етил алкохол, врсте алкометар, калијум дихромат, горивне ћелије, катализатор, ослобађање електрона, сирћетна киселина, водоник, конц



