Један поларно једињење (или супстанца) је онај који има два региона са различитим густинама електрона. Један од ових региона има позитиван карактер (бела област), а други негативан карактер (жута област), као што можемо видети на следећем приказу:

Представљање области различитог наелектрисања у поларном једињењу
Знати да ли је извесно композит је поларни подразумева познавање врсте међумолекулске силе која фаворизује интеракцију између њених молекула или са молекуле других супстанци, као и давање претпоставки о њиховој растворљивости и тачкама топљења и кључање.
На пример: у погледу растворљивости, поларна једињења имају добру способност растварања у поларна једињења. Што се тиче међумолекулских сила, у зависности од случаја, поларна једињења могу да делују силама трајне диполне или водоничне везе (јачина која такође резултира вишим тачкама топљења и кључање).
Ево два практична начина да одредите да ли је једињење поларно или не.
Одређивање поларитета кроз број облака и број лиганада
Можемо утврдити да ли а
композит је поларни односом између броја једнаких атома везаних за централни атом и броја електронских облака у том централном атому.Белешка: Електронски облак је свака хемијска веза између два атома, или пар електрона из валентне љуске атома који не учествују у вези.
Ако се број облака присутних у централном атому разликује од броја једнаких лиганада у том централном атому, имамо поларно једињење. Да бисте боље разумели, пратите примере у наставку:
1. пример: Молекул цијановодоничне киселине
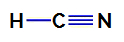
Структурна формула цијановодоничне киселине
У цијановодоничној киселини, централни атом је угљеник, који у себи има четири електрона валентни слој за припадност ИВА породици периодног система. Како угљеник прави једноструку везу (дели два електрона, са једним електроном из сваког атома укључени) са водоником и троструком везом са азотом, тако да у атому нема електрона који не везују централни.
Дакле, у цијановодоничној киселини постоји присуство два електронска облака (једнострука и трострука веза) и лиганда који је једнак другом. Стога је а поларно једињење.
2. пример: Молекул амонијака (НХ3)
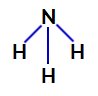
Структурна формула амонијака
У амонијаку, централни атом је азот, који има пет електрона у својој валентној љусци јер припада ВА породици периодног система. Пошто азот прави једноструку везу (дељење два електрона, са једним електроном од сваки укључен атом) са сваким атомом водоника два од његових пет електрона не учествују у везама.
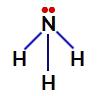
Електрони који не везују азот у амонијаку
Дакле, у амонијаку постоје четири електронска облака (три једноструке везе и невезујући електронски пар) и три једнака лиганда (три водоника). Дакле, то је а поларно једињење.
Одређивање поларитета кроз вектор диполног момента једињења
Можемо утврдити да ли а композит је поларни анализом на резултујући вектор диполног момента у својој структурној формули, узимајући у обзир своје молекуларна геометрија и разлика од електронегативност између укључених атома.
Белешка: Опадајући ред електронегативности елемената: Ф > О > Н > Цл > Бр > И > С > Ц > П > Х.
Када се збир вектора присутних у молекулу разликује од нуле, једињење ће бити поларно. Да бисте боље разумели, пратите следеће примере:
1. пример: молекул трихлорометана
Трихлорометан је једињење које представља тетраедарска геометрија, као што можемо видети у његовој структурној формули у наставку:

Структурна формула трихлорометана
Да бисмо сазнали да ли је то поларно једињење или не, морамо прво поставити векторе диполног момента (стрелице које показују који је атом стабилнији од другог) у структурни, као у следећем примеру:
Белешка: Хлор је електронегативнији елемент од угљеника. Заузврат, угљеник је више електронегативни елемент од водоника.
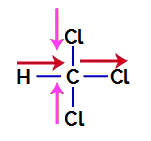
Вектори диполног момента у трихлорометану
Вектори у ружичастој могу бити представљени са +к и -к, пошто имају исти правац (вертикалан) и супротан смер (горе и доле). Вектори у црвеној су представљени са +к, пошто имају исти правац и исти правац. Дакле, резултујући вектор диполног момента (збир вектора) је представљен са:
μр = (+к) + (-к) + (+к) + (+к)
μр = +Кс – к + к + к
μр = 2к
Пошто је резултујући вектор диполног момента различит од нуле, имамо а поларно једињење.
2. пример: молекул воде
Вода је једињење које представља угаона геометрија, као што можемо видети у његовој структурној формули у наставку:
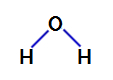
Структурна формула воде
Да бисмо сазнали да ли је то поларно једињење или не, морамо прво поставити векторе диполног момента (стрелице које показују који је атом стабилнији од другог) у структуру, као што је приказано у наставку:
Белешка: Кисеоник је електронегативнији елемент од водоника.
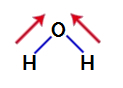
вектори диполног момента у води
Пошто су два вектора у структури воде дијагонално, морамо користити правило паралелограма. У овом правилу, када повежемо базе вектора, имамо креирање резултујућег вектора (који замењује два претходно коришћена), као у следећем моделу:
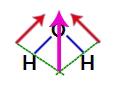
Резултујући вектор у структурној формули воде
Како молекул воде има један вектор, резултујући вектор диполног момента је различит од нуле, односно имамо поларно једињење.
Од мене Диого Лопес Диас
Извор: Бразил школа - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-um-composto-polar.htm
