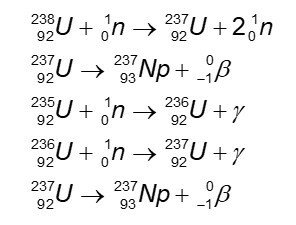ТХЕ титрација је лабораторијски поступак који се користи за одређивање концентрације у количини материје (или концентрација у мол/Л) раствора који садржи киселину или базу.
Током титрације увек постоји а мешавина раствора који садрже различите растворене супстанце са појавом хемијске реакције. Како мешани раствори увек имају киселину и базу, хемијска реакција која се одвија је а неутрализација.

Хемијска једначина која представља титрацију.
Поступак за одређивање моларне концентрације непознатог раствора током титрација зависи од следећих фактора:
• Знати моларну концентрацију раствора који ће бити помешан са непознатом;
• Знати запремину раствора непознате концентрације;
• Знати запремину раствора познате концентрације.
Формула која се користи у титрацији
А у титрација долази до неутрализације (једнак број молова киселине и базе), можемо користити следећу формулу да одредимо моларну концентрацију непознатог раствора:
неТхе = нБ
МТхе.ВТхе = МБ.ВБ
Белешка: Број молова је производ између моларне концентрације (М) и запремине раствора (В).
Опрема потребна за обављање дипломе
• Бирета: опрема која се користи за мерење запремине раствора познате концентрације;

• Ерленмајер: опрема која се користи за пријем раствора непознате концентрације;

• Универзални ослонац: опрема на коју је причвршћена канџа;

• Канџа: опрема која се користи за држање бирете;

• Магнетна мешалица: опрема која се користи за мешање раствора који се налази у ерленмајерској тиквици.

Степенице дипломе
-
1. фаза: причврстите бирету на универзални носач помоћу канџе;
-
2. фаза: поставити ерленмајер на магнетну мешалицу;
-
3. фаза: додати одређену запремину, унутар Ерленмајерове боце, раствора непознате концентрације. На пример: додати 10 мЛ раствора у ерленмајер;
- 4. фаза: додати фенофталеин у раствор који се налази у Ерленмајеровој тиквици.
Напомена: Ако је раствор у ерленмајерској тиквици кисео, када се додаје фенолфталеин, раствор остаће непромењене боје, међутим, ако је раствор базичан, биће розе црвенкаста.

Фенолфталеин је додат основном карактеристичном раствору.
-
5. фаза: додајте магнетну шипку унутар Ерленмајерове боце. Затим укључите магнетну мешалицу тако да се течност унутар Ерленмајера меша;
-
6. фаза: додати у бирету, до њеног максималног капацитета, запремину раствора познате концентрације, односно ако је бирета 50 мЛ, додати 50 мЛ овог раствора.
- 7. корак: отворите биретни вентил и дозволите да течност из његове унутрашњости падне у ерленмајер.
Запажања у току титрације
Чим се бирета отвори на ерленмајерској тиквици, почиње реакција неутрализације, односно киселина реагује са базом, постепено формирајући со и воду.
Како се реакција неутрализације дешава са смешом, боја раствора присутна у Ерленмајер се такође постепено мења, што називамо прекретницом, на следећи начин:
- Ако је било безбојно, почиње да изгледа розецрвенкаста,
- ако јерозецрвенкаста, почиње да постаје безбојан.

Представљање тачке преокрета у титрацији.
Када раствор присутан у ерленмајерици потпуно промени боју, односно дође до тачке преокрета, кажемо да је титрација завршена. У том тренутку само проверите употребљену запремину раствора познате концентрације која се налазила на бирети.
Из збира између запремине раствора познате концентрације, која је одређена у бирети, и запремине непознатог раствора, који је био ерленмајер, у позицији смо да одредимо његову концентрацију молар.
Од мене Диого Лопес Диас
Извор: Бразил школа - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-titulacao.htm