Кп је акроним који се користи за одређивање константа равнотеже у смислу парцијалних притисака. Ова константа ради са вредностима гасовитих учесника равнотеже у јединици атм, на пример.

Једначина која представља хемијску реакцију са гасовитим компонентама
У овој једначини, сви учесници су гасовити, па када гас који учествује има а парцијални притисак у смеши, представљена је скраћеницом пКс.
Приликом постављања једначине хемијске равнотеже (у смислу концентрације), производи се морају ставити у бројилац, а реактанти се стављају у именилац:
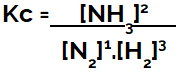
Кц експресија равнотеже формирања амонијака
израз од константа равнотеже у смислу притиска (Кп) прати образац Кц, односно парцијални притисци реагенаса су позиционирани у именилац, а парцијални притисци производа у бројиоцу:
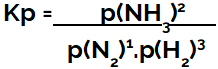
Кп експресија равнотеже формирања амонијака
запажање: Ако је једначина реакције од хемијска равнотежа не представља гасовитог учесника, неће се аутоматски представити Кп.
Пример: (ПУЦ-МГ) За реакцију: 2 ЦО(г) + О2(г)? 2 ЦО2(г), парцијални притисци ЦО
(г) то је2(г) у равнотежи су, респективно, 0,2 атм и 0,4 атм. Укупан притисак система је 1,4 атм. Вредност Кп јер је реакција:а) 56.2
б) 40,0
ц) 35.6
д) 28.4
е) 25.6
Подаци добијени вежбом су:
Парцијални притисак угљен-моноксида (пЦО) = 0,2 атм;
Парцијални притисак угљен моноксида (пО2) = 0,4 атм;
Укупан притисак =1,4 атм;
Да бисмо одредили Кп овог система, морамо извршити следеће кораке:
1. корак: Одредите парцијални притисак угљен моноксида (пЦО2).
За ово, само запамтите да је укупан притисак (пт) збир свих парцијалних притисака:
пт = пЦО + пЦО2 + пО2
1,4 = 0,2 + п (ЦО2) + 0,4
1,4 - 0,2 - 0,4 = пЦО2
пЦО2 = 0,8 атм
2. корак: Одредити Кп вежбе.
За ово само користите вредности у изразу константе равнотеже Кп:
Кп = (пЦО2)2
(пЦО)2.(прашина2)1
Кп = (0,8)2
(0,2)2.(0,4)1
Кп = 0,64
0,04.0,4
Кп = 0,64
0,016
Кп = 40 атм-1
Од мене Диого Лопес Диас
Извор: Бразил школа - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-kp.htm
