Осмоза је кретање воде које се одвија унутар ћелија кроз полупропусну мембрану.
У овом процесу молекули воде се премештају из мање концентрованог у концентрисанији медијум.
Због тога осмоза служи за уравнотежење две стране мембране, што доводи до растварања медијума богате растворима растварачем, а то је вода.
Како настаје осмоза?
Осмоза се сматра пасивним транспортом, као у пролазу кроз мембрану не троши се енергија.
У процесу осмозе, вода, која је растварач, тежи да пређе полупропусну мембрану да би уравнотежила концентрацију раствора. Ова акција се изводи док се осмотски притисак не стабилизује.
Према томе, вода се природно креће из мање концентрованог региона у концентрисанији.
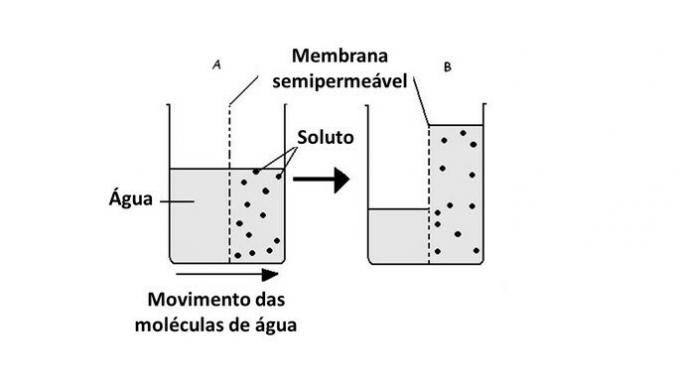
Пролазак воде из једног медијума у други врши се у ћелијама уз помоћ транспорта протеина у мембрани, аквапорина. Дакле, осмоза се јавља кад год постоји разлика у концентрацији између спољног и унутрашњег окружења ћелије.
Резултат осмозе се користи у процесима размене хранљивих састојака животињских и биљних ћелија.
Такође прочитајте о Пасиван транспорт и Активни превоз.
Хипотонично, изотонично и хипертонично решење
Као што смо видели, процес осмозе има за циљ изједначавање концентрација раствора, док се не постигне равнотежа. За ово имамо следеће врсте решења:
- хипертонично решење: представља већи осмотски притисак и концентрацију растворених супстанци.
- хипотонично решење: представља нижи осмотски притисак и концентрацију растворених супстанци.
- изотонични раствор: концентрација растворене супстанце и осмотски притисак су једнаки, чиме се постиже равнотежа.
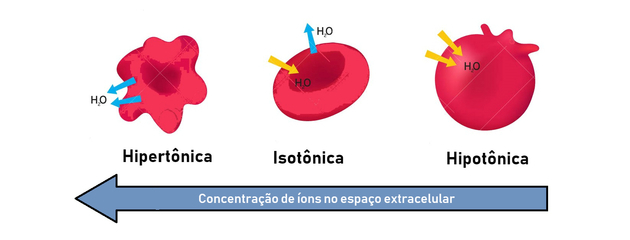
Стога се осмоза јавља између хипертоничног (концентрисанијег) и хипотоничног (мање концентрисаног) начина стварања равнотеже.
примери осмозе
У ћелијама, плаземска мембрана је омотач формиран двослојем липида, који омета кретање воде у ћелији. Међутим, постоје протеини специјализовани за његову структуру, аквапорини, који делују као канали који олакшавају пролазак молекула воде.
У хипертоничном окружењу, ћелије имају тенденцију да се смањују јер губе воду. Ћелија смештена у хипотоничном медијуму може да бубри док се не сломи, јер долази до кретања воде у ћелију.
У наставку погледајте како се осмоза јавља у животињским и биљним ћелијама.
Осмоза у животињским ћелијама
када животињска ћелија, попут црвених крвних зрнаца, изложени су медијима различитих концентрација, кретање воде у ћелији се одвија на следећи начин:
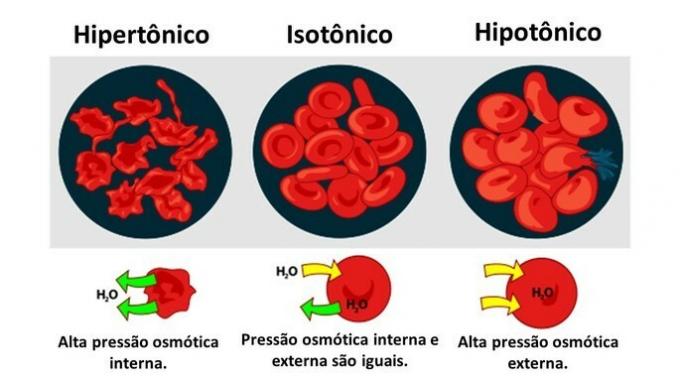
Када је медијум богат раствором, раствором који је хипертоничан у односу на цитоплазму, ћелије губе воду у медијуму и вену.
Када је медијум сиромашан раствореном супстанцом, хипотоничним раствором, молекули воде теже да уђу у ћелију и, иако је мембрана отпорна, у зависности од количине, може доћи до поремећаја.
Осмоза биљних ћелија
Кретање воде у биљним ћелијама одвија се између ћелијске вакуоле и ванћелијске околине.
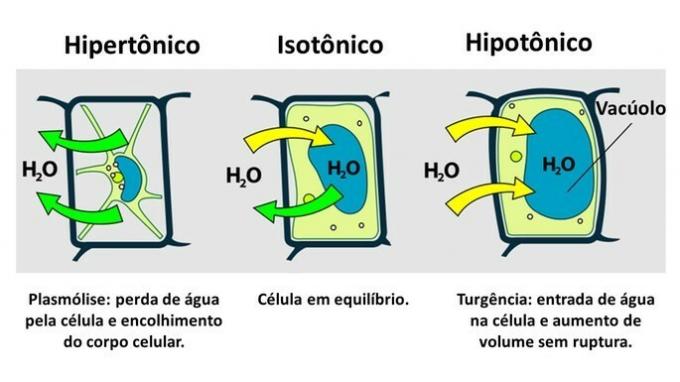
ТХЕ биљних ћелија има поред плазматске мембране врло отпоран ћелијски зид који је формиран од целулозе.
Стога се, за разлику од животињске ћелије, биљна ћелија опире прекидима када се убаци у хипотонично окружење, где вода тежи да уђе у ћелију. Ћелија набрекне, повећавајући запремину, али ћелијски зид спречава пуцање.
Губитак воде од стране биљне ћелије, која се убацује у хипертонично окружење, назива се плазмолиза. Улазак воде у вакуолу када је ћелија у хипотоничном медијуму назива се тургенција, када долази до повећања запремине ћелије.
Како осмотски притисак утиче на осмозу?
Растворена супстанца је било која супстанца која се може разблажити у растварачу, као што је шећер растворен у води. Док је осмотски притисак притисак који је створен за кретање воде.
Како је осмоза процес који се одвија од најмање концентрованог (хипотоничног) до најконцентрисанијег (хипертоничног) медија у у потрази за равнотежом, осмотски притисак је притисак који се врши на систем како би се спречило да се осмоза догоди природно.
Стога, што је већа разлика у концентрацији између хипертоничног и хипотоничног медија, већи би требао бити осмотски притисак који се примењује на концентриранији раствор да би се избегла осмоза.
Сазнајте више о осмотски притисак.
Шта је реверзна осмоза и како то делује
Обрнута осмоза је пролазак воде у супротном смеру од осмозе. Тако се вода премешта из концентриранијег раствора у мање концентровани раствор.
Обрнута осмоза се дешава притиском већим од природног осмотског притиска.
Како полупропусна мембрана дозвољава само пролазак растварача (чиста вода), задржава растворене материје.
Пример реверзне осмозе је трансформација слане воде у слатку водом поступком десалинизације.
Сазнајте више о обрнути осмоза.
Разлика између осмозе и дифузије
Дифузија је пролазак врло малих молекула гасова и растворених супстанци растворених у води Плазма мембране. У овом случају, молекули растворене супстанце ће се пребацити из концентрираније средине у мање концентровану средину. Крећу се градијентом концентрације и шире се по расположивом простору.
ТХЕ Олакшана дифузија то је пролазак кроз мембрану супстанци које се не растварају у липидима уз помоћ протеина који прожимају липидни двослој.
Попут осмозе, и дифузија се такође сматра а пасиван транспорт, јер се јавља у корист градијента концентрације.
Радозналост
Израз „учење осмозом“ широко користе студенти који би желели да науче нове садржаје без да морају да уче, односно без напора.
Прочитајте такође:
- Растворени раствор и растварач
- Натријум и калијум пумпа
- Селективна пропустљивост

