* Аррениусова теорија:
На основу његових експеримената са електричном проводљивошћу у воденим медијима, хемијским, физичким и математичким Швед Сванте Аугуст Аррхениус (1859-1927) предложио је 1884. године следеће концепте за дефинисање киселина и базе:

Дакле, опћенито имамо:
Х.+ + Х2О → Х.3О.+
Примери:
ХЦл + Х.2О → Х.3О.++ Кл-
ХНО3+ Х2О → Х.3О.+ + НЕ3-
Х.2САМО4+ 2Х2О → 2Х3О.+ + ОС42-

Примери:
НаОХ → На + + ОХ-
Ца (ОХ)2 → Ца2+ + 2 ОХ-
* Бронстед-Ловри теорија:
Независно, Дански Јоханнес Ницолаус Бронстед (1879-1947) и Енглез Тхомас Мартин Ловри (1874-1936), исте године је предложио још једну теорију о киселинама и базама, познату као Бронстед-Ловри теорија, која каже да Следећи:

У овом случају, водоник-јон се сматра протоном. То се види у следећој реакцији, где цијановодонична киселина донира протон води, која стога делује као база:
ХЦН + Х.2О → ЦН- + Х3О.+
Ова реакција је реверзибилна, са јоном хидронијума (Х3О.+) може донирати протон ЦН јону-. Дакле, јон хидронијума (Х.3О.+) делује као киселина и ЦН- као основа.
ЦН- + Х3О.+→ ХЦН + Х2О.
* Левисова теорија:
Ову теорију је створио амерички хемичар Гилберт Невтон Левис (1875-1946) и каже следеће:

Ова теорија уводи нови концепт, свеобухватнија је, али не поништава Бронстед-Ловри теорију. Јер свака Левисова киселина је Бронстедова киселина, па је стога свака Левисова база Бронстедова база. То је зато што протон прима електроне, што значи да се Луисова киселина може придружити усамљеном пару електрона у Луисовој бази.
За Луиса, киселинско-базна реакција састоји се у стварању стабилније координисане ковалентне везе. Дакле, када Луисова база поклони пар електрона Луисовој бази, обојица формирају а координатна ковалентна веза, у којој оба електрона потичу из једног од атома, као у примеру доле:
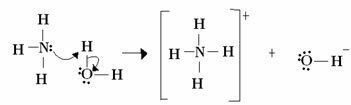
У овом случају, амонијак делује као Левисова и Бронстедова база, јер донира своја два електрона протону и стога је прималац протона. Поред тога, формирана је ковалентна веза између водоника (протона) и амонијака.
Вода је Луисова киселина и Бронстедова киселина, јер донира протон и прима електроне, примети како кисеоник у хидроксиду који настаје из воде има додатни пар електрона.

Јеннифер Фогаца
Дипломирао хемију
Бразилски школски тим.
Извор: Бразил Сцхоол - https://brasilescola.uol.com.br/quimica/teorias-acidobase-arrheniusbronstedlowry-lewis.htm

