Расподела електрона или електронска конфигурација начин на који су хемијски елементи поређани с обзиром на број електрона који имају и њихову близину атомском језгру.
Електронска степенаста дистрибуција
Након што се појавило неколико атомских модела, Боров модел је предложио организацију електросфере у орбите.
Електрони су организовани и распоређени кроз електронске слојеве, неки су ближе језгру, а други даље.
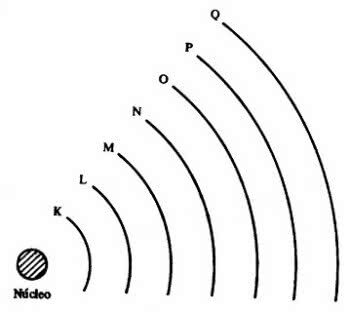
Затим је дошло 7 електронских слојева (К, Л, М, Н, О, П и К), који су представљени хоризонталним линијама означеним бројевима од 1 до 7 у периодном систему.
Елементи на истим линијама имају исти максималан број електрона и такође исти ниво енергије.
Стога је могуће уочити да су електрони у енергетским нивоима и поднивоима. Дакле, свака има одређену количину енергије.
|
Ниво енергије |
Електронски слој |
Максималан број електрона |
|---|---|---|
| 1° | К. | 2 |
| 2° | Л | 8 |
| 3° | М. | 18 |
| 4° | Н. | 32 |
| 5° | О. | 32 |
| 6° | П. | 18 |
| 7° | К | 8 |
ТХЕ валентни слој то је последњи електронски слој, односно најудаљенији слој атома. Према Правило октета, атоми имају тенденцију да се стабилизују и постану неутрални.
То се дешава када имају исту количину протона и неутрона, са осам електрона у последњој електронској љусци.
Касније су се појавили поднивои енергије, представљени малим словима с, п, д, ф. Сваки подниво подржава максимални број електрона:
| поднивои | Максималан број електрона |
|---|---|
| с | 2 |
| П. | 6 |
| д | 10 |
| ф | 14 |
Паулингов дијаграм
Амерички хемичар Линус Царл Паулинг (1901-1994) проучавао је атомске структуре и развио шему која се користи и данас.
Паулинг је пронашао начин да све енергетске поднивое стави у растући редослед, користећи дијагонални правац. Шема је постала позната као Паулингов дијаграм.
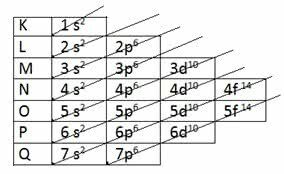
Примање наруџбине: 1с2 2с2 2п6 3с2 3п6 4с2 3д10 4п6 5с2 4д10 5п6 6с2 4ф14 5д10 6п6 7с2 5ф14 6д10 7п6
Имајте на уму да број назначен испред нивоа енергије одговара нивоу енергије.
На пример, за 1с2:
- с означава енергетски подниво
- 1 означава први ниво који се налази на слоју К.
- експонент 2 означава број електрона у овом поднивоу
Како се врши електронска дистрибуција?
Да бисте боље разумели поступак електронске дистрибуције, погледајте решену вежбу у наставку.
1. Извршити електронску дистрибуцију елемента Гвожђе (Фе) који има атомски број 26 (З = 26):
Приликом примене Линус Паулинг дијаграма, дијагонале се прелазе у смеру назначеном у моделу. Енергетски поднивои су испуњени максималним бројем електрона по електронској љусци, све док не заврши 26 електрона елемента.
Да бисте извршили расподелу, обратите пажњу на укупан број електрона у сваком подниву и у одговарајућим електронским слојевима:
К - с2
Л - 2с2 2п6
М - 3с2 3п6 3д10
Н - 4с2
Имајте на уму да није било потребно вршити електронску дистрибуцију у свим слојевима, јер је атомски број гвожђа 26.
Дакле, електронска дистрибуција овог елемента представљена је на следећи начин: 1с2 2с2 2п6 3с2 3п6 4с2 3д6. Збир бројева експонената износи 26, односно укупан број електрона присутних у атому гвожђа.
Ако је електронска дистрибуција означена слојевима, она је представљена на следећи начин: К = 2; Л = 8; М = 14; Н = 2.
Искористите прилику да тестирате своје знање у Вежбе о електронској дистрибуцији.
У Периодни систем, ово је приказано на следећи начин:

Прочитајте такође:
- Електронски афинитет
- Квантни бројеви
- Вежбе на периодном систему
- Вежбе на организовању периодног система