Према моделу орбитала који је створио Линус Паулинг 1960. године, ковалентна веза која формира молекула настаје фузијом или међусобним продирањем непотпуних орбитала елемената који учествују у Линк. Дакле, закључује се да ако елемент има непотпуну орбиталу (са само једним електроном), он може да направи само ковалентну везу. Ако има две непотпуне орбитале, може да оствари највише две везе и тако даље.
Међутим, погледајте атомске орбитале елемента атома угљеника, који има атомски број једнак 6 (З = 6):
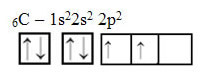
Имајте на уму да има две непотпуне орбитале, па би требало да изврши само два везивања. Међутим, то му се не дешава. Као што многи знају, угљеник ствара четири везе (четверовалентни је), па овај модел орбитала не објашњава случај угљеника.
Да би се окончао овај ћорсокак, створена је нова теорија која је боље објаснила ово питање: Теорија хибридизације.

То значи да је хибридизација „мешавина“ чистих орбитала.
За угљеник постоје три врсте хибридизације, а то су: сп3, сп2 и сп.
Да бисмо разумели како долази до хибридизације, погледајмо први тип хибридизације угљеника, сп тип.3:
Ова врста хибридизације се јавља у молекулу метана (ЦХ4). Имајте на уму да постоје четири идентичне ковалентне везе између угљеника, који је централни елемент, и четири водоника. Па, погледајте шта је непотпуна водонична орбитала:
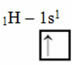
Како сваки водоник има непотпуну орбиталу с-типа, неопходно је примити још један електрон, односно сваки ствара само једну ковалентну везу са угљеником. Због тога угљеник треба да има четири непотпуне орбитале. Како се ово дешава? Кроз хибридизацију.
Када електрон из 2с орбитале упије енергију, он прелази у празну 2п орбиталу. Дакле, кажемо да је овај скок електрона са 2с на 2п подниво „промоција“ електрона. На овај начин, угљеник остаје у свом побуђеном или активираном стању, са четири хибридизоване орбитале које су на располагању за спровођење ковалентних веза:
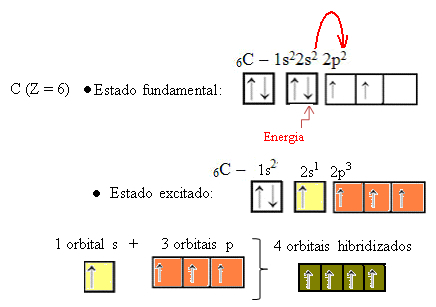
Имајте на уму да су формиране хибридне орбитале једнаке једна другој, али се разликују од оригиналних чистих орбитала.
На овај начин, веза између с орбитале сваког од четири атома водоника се јавља са ове четири хибридизоване орбитале угљеника:
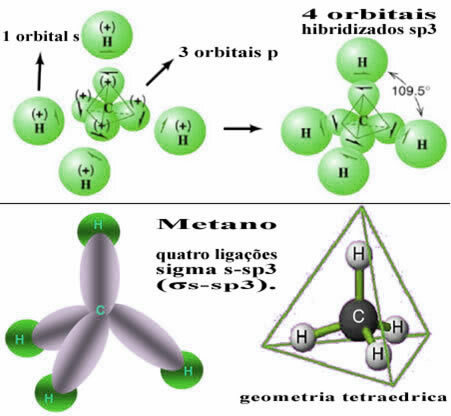
Као што се види горе, молекул метана има правилну структуру тетраедра, са четири облака електрона у сваком врху и суседним угловима од 109 ° 28 ’. Пошто је веза направљена између с орбитале сваког водоника и хибридизоване сп орбитале3 за сваки позив, онда имамо да јесу четири сигма с-сп везе3 (σс-сп3).
Јеннифер Фогаца
Дипломирао хемију
Извор: Бразил Сцхоол - https://brasilescola.uol.com.br/quimica/hibridizacao-tipo-sp3.htm


