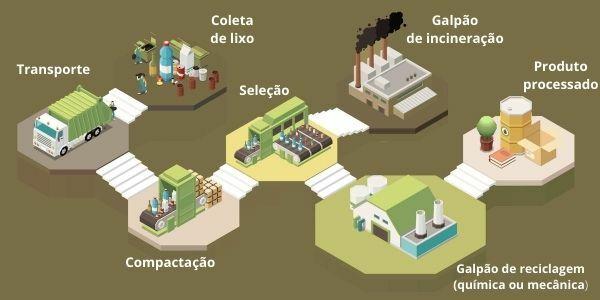
Један од начина на који су хемијски елементи организовани је путем породица, које одговарају вертикалним секвенцама периодног система.
У 18 колона табеле груписати елементе према сличностима у хемијским својствима.
Организовање хемијских елемената у породице био је практичан начин структурирања различитих пронађених информација и њиховог представљања на једноставан начин.
Да би се олакшало лоцирање хемијског елемента, породице су означене бројевима од 1 до 18 на следећи начин:
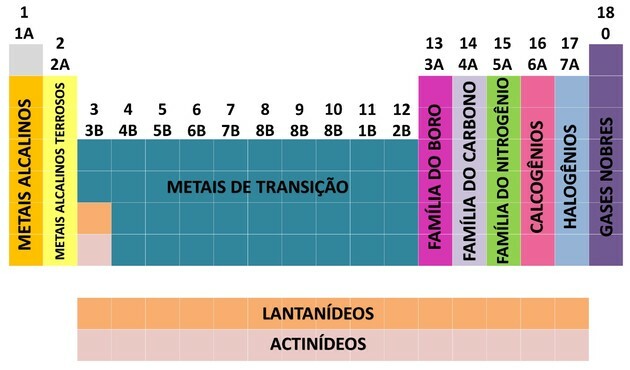
Захваљујући доприносу многих научника и различитим покушајима да се поређају подаци, периодни систем је еволуирао успостављајући поредак за сређивање елемената.
Номенклатура породица
- Породице у табели подељене су на А (репрезентативне) и Б (транзиционе), идентификоване словима и бројевима.
- ти репрезентативни елементи одговарају породице 0, 1А, 2А, 3А, 4А, 5А, 6А и 7А.
- ти прелазни елементи одговарају породице 1Б, 2Б, 3Б, 4Б, 5Б, 6Б, 7Б и 8Б.
- Одређивањем Међународне уније за чисту и примењену хемију (ИУПАЦ), породице су идентификоване у групе од 1 до 18.
Периодни систем и електронска дистрибуција
До сличности између елемената исте породице долази зато што је број валентних електрона атома у основном стању једнак за чланове одређене групе.
На пример:
| 1. група | Елетрониц дистрибуција |
|---|---|
| 3читати | 2-1 |
| 11У | 2-8-1 |
| 19К. | 2-8-8-1 |
| 37Рб | 2-8-18-8-1 |
| 55Цс | 2-8-18-18-8-1 |
| 87Фр | 2-8-18-32-18-8-1 |
Атоми групе 1 имају своје електроне распоређене на више од једног енергетског нивоа, али сви имају валентни електрон.
Уз то, примећујемо да је прављење електронска дистрибуција атома у основном стању, налазимо његов положај на периодном систему.
репрезентативни елементи
Репрезентативни елементи показују релативно мање сложено хемијско понашање од прелазних елемената и чине већину супстанци око нас.
Неке од репрезентативних породица елемената добијају посебна имена, као што је приказано у наставку:
Група |
Породица | одређено име | Порекло имена | Елементи | електронска конфигурација |
|---|---|---|---|---|---|
| 1 | 1А | алкални метали | од латинског алкална, што значи „сиве биљке“. | Ли, На, К, Рб, Цс и Фр | нас1 |
| 2 | 2А | земноалкални метали | Израз „земаљски“ односи се на „постојање на земљи“. | Буди, Мг, Ца, Ср, Ба и Ра | нас2 |
| 13 | 3А | породица бора | Име првог елемента породице. | Б, Ал, Га, Ин, Тл и Нх. | нас2нп1 |
| 14 | 4А | породица угљеника | Име првог елемента породице. | Ц, Си, Ге, Сн, Пб и Фл. | нас2нп2 |
| 15 | 5А | Породица азота | Име првог елемента породице. | Н, П, Ас, Сб, Би и Мц. | нас2нп3 |
| 16 | 6А | Халкогени | од грчког кхалкс, пошто се ради о елементима који се налазе у рудама бакра. | О, С, Се, Те, По и Лв. | нас2нп4 |
| 17 | 7А | Халогени | Грчки израз у значењу творци соли. | Ф, Цл, Бр, И, Ат и Тс. | нас2нп5 |
| 18 | 0 | Племените гасове | Сматрало се да не реагује са другим супстанцама. | Он, Не, Ар, Кр, Ксе, Ре и Ог. | 1с2 (Он) или ми2нп6 |
Кроз табелу можемо видети да:
- Елементи представљени горе су класификовани као репрезентативни јер имају најенергичнији електрон у с или п поднивоу.
- Електрони су распоређени по нивоима енергије и н представља најудаљенији ниво атома у основном стању.
- Репрезентативни елементи, према препоруци ИУПАЦ-а, припадају групама или породицама 1,2,13,14,15,16,17 и 18.
О. водоник класификован је одвојено од осталих елемената. Чак и са 1с електронском конфигурацијом1, он није део групе 1 због представљања појединачног понашања.
прелазни елементи
Прелазни елементи одговарају групама 3 до 12. Ово име добијају зато што имају средње карактеристике између група 1 и 2 и репрезентативних неметалних елемената.
ти прелазних метала су дефинисани од стране ИУПАЦ као:
Прелазни елемент има непотпуни д подниво или може формирати катионе са непотпуним д подразином.
Када је најенергичнији електрон атома у основном стању у непотпуном под нивоу, то се карактерише као спољни прелаз.
Лантаниди и актиниди су унутрашњи прелазни елементи јер имају најмање један непотпуни подниво.
Када елементи имају електроне који испуњавају д или ф орбитале, они показују слична својства и могу се класификовати у елементе од спољни или унутрашњи прелаз.
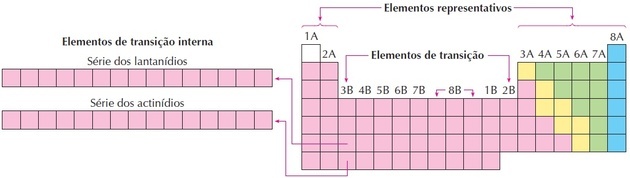
Као што видимо на слици, породица 8Б одговара 3 колоне, то су групе 8, 9 и 10, које су овако груписане јер имају сличне карактеристике.
Главне карактеристике породица
Табела у наставку приказује главна својства група у периодном систему:
| Група | Карактеристике | сложене супстанце чешћи |
појаве |
|---|---|---|---|
| 1 | Чврст и сјајан у амбијенталним условима. Веома реактивни, мекани и добри проводници електричне енергије. | Соли, хидроксиди и оксиди |
Реагујте са халогенима и формирајте соли. |
| 2 | Мање реактиван и тежи од групе 1. Чврсте материје сребра добре проводљивости. | Соли, хидроксиди и оксиди |
Стварање соли и оксида. |
| 3 до 12 | Они чине комплексе. Они су металне чврсте материје, тврде и ломљиве, са изузетком живе која је течност. | Соли, оксиди и комплекси. Нпр.: АгНО3, ТиО и [Цр (ОХ)3(Х2О)3] |
У минералима у облику оксида. |
| 13 | Чврсте материје у амбијенталним условима, сребро, осим бора. | Оксиди Пример: Б.2О.3 |
У минералима у облику оксида. |
| 14 | Чврст у амбијенталним условима. | Атоми Ц и Си могу се распоредити у ланце и створити огромну разноликост супстанци. | У живим организмима и у облику силиката или оксида. |
| 15 | Чврсте материје, осим азота, који је гасовит у амбијенталним условима. | Оксиди и киселине Нпр: НЕ2 и Х.3ДУСТ4 |
Атмосфера, живи организми и минерали. |
| 16 | Чврсте материје, осим кисеоника, који је гасовит у амбијенталним условима. | Сулфиди и оксиди Нпр: ЗнС и СиО2 |
Атмосфера, живи организми и минерали. |
| 17 | Они формирају двоатомске молекуле и врло су реактивни. Лоши су проводници електричне енергије и топлоте. Они су агресивни према живим бићима и околини. | Киселине и соли. Пример: ХЦл и КБр |
Присутни су у супстанцама органске и минералне. |
| 18 | Веома су стабилни и налазе се у облику гасова. | Тешко формирају једињења једињења. | Гасови у атмосфери. |
Хемијска и физичка својства разликују једну породицу од друге. Као што смо видели, хемијска својства су повезана са електрони валенције, и преко њих атом ступа у интеракцију са другим, одговоран за хемијско понашање и хемијске везе формирана.
Физичка својства елемената у истој групи могу се разликовати у зависности од атомског броја и масе.
Вежбе
Сада када знате мало више о породицама Периодног система, тестирајте своје знање и погледајте шта сте научили.
1) Размотрите следећи извод из Периодног система.
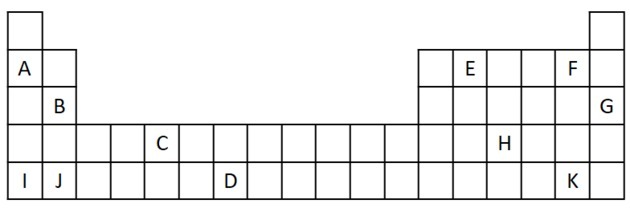
а) Наведи два елемента која имају два валентна електрона.
б) Означите елемент који бурно реагује са водом производећи метални хидроксид.
ц) Означити нереактивни елемент.
г) Наведите два елемента која се комбинују са алкалним металима да би створили соли.
Одговорити:
а) Б и Ј
Два валентна електрона одговарају групи 2 која има нс електронску конфигурацију2 а у вежби их представљају Б и Ј.
б) А, Б, И или Ј.
А и И представљају елементе породице 1; Б и Ј су из породице 2. Као што смо видели у табели својстава, елементи 1 и 2 групе су врло реактивни и могу формирати хидроксиде, као у датим примерима: КОХ и Мг (ОХ)2.
ц) Г.
Племенити гасови су врло стабилни и стога нису врло реактивни. Слово Г је уметнуто у табелу као елемент ове породице.
г) Ф и К.
Халогени реагују са алкалним металима да би створили соли. Најчешћи пример за то је кухињска со, НаЦл.
2) Следећа слика приказује три хемијска елемента, с лева на десно, литијум, натријум и калијум.

Изаберите опцију која исправно довршава сваку од следећих изјава.
1.1) „Можемо рећи да литијум, натријум и калијум ...
(А)... припадају истом периоду. “
(Б)… има исти атомски број. “
(Ц)… припадају истој групи. “
(Д)… има исти масени број. “
1.2) „Елементи литијум, натријум и калијум ...
(А)... има врло слична хемијска својства. “
(Б)... има врло различита хемијска својства. “
(Ц)... су неметали. “
(Д)… реагујте са водом да бисте створили киселе растворе. “
Одговори:
1.1) (Ц) припадају истој групи.
1.2) (А) има врло слична хемијска својства.
Ове информације можемо добити консултовањем периодног система или електронском расподелом елемената литијум, натријум и калијум. Видећемо да њих тројица имају електрон у валентној љусци и зато што су део исте групе, хемијска својства су врло слична.
3) Размотрите следећу табелу, где су представљени атомски бројеви и електронска расподела неких хемијских елемената.
| Елемент | хемијски симбол | атомски број | Елетрониц дистрибуција |
|---|---|---|---|
| Литијум | читати | 3 | 2,1 |
| Берилиј | бити | 4 | 2,2 |
| Флуор | Ф | 9 | 2,7 |
| неон | Хух | 10 | 2,8 |
| хлор | Кл | 17 | 2,8,7 |
| аргон | Ваздух | 18 | 2,8,8 |
| Калијум | К. | 19 | 2,8,8,1 |
| Калцијум | Ево | 20 | 2,8,8,2 |
Наведите групу сваког елемента.
Одговорити:
Литијум и калијум: група 1. (Имају електрон у валентној љусци).
Берилијум и калцијум: група 2. (У валентној љусци имају два електрона).
Флуор и хлор: група 17. (У валентној љусци имају седам електрона).
Неон и аргон: група 18. (У валентној љусци имају осам електрона).
Проверите питања пријемног испита са коментарисаном резолуцијом у Вежбе на периодном систему и необјављена питања на ту тему у Вежбе на организовању периодног система.